
题目列表(包括答案和解析)
 (1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
|
|
|
| O | - 3 |
| ||
| ||
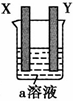
反应C(s)+H2O(g)![]() CO(g)+H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是____________。
CO(g)+H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是____________。
①增加C的量 ②将容器的体积扩大一倍 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
(4分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
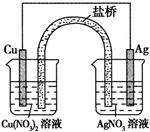
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,
其负极反应为:
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)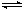 CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如图所示。下列说法错误的是
CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如图所示。下列说法错误的是

A.该反应的ΔH>0
B.若T1、T2时的平衡常数分别为K1、K2,则K1=K2
C.通过加热可以使B点变到C点
D.在T2时若反应进行到状态D,则一定有υ(正) <υ(逆)
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g) CO(g)+H2(g),其中H2O 、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
CO(g)+H2(g),其中H2O 、CO的物质的量(mol)随时间(min)的变化曲线如图所示: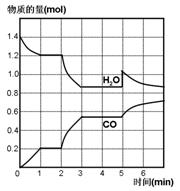
(1)该反应的化学平衡常数表述式为__________________
(2)计算1min内υ(CO)=______________
(3)反应处于平衡状态的时间区间是_______________
(4)若反应进行到2min时,改变了温度,使曲线发生如右图所示的变化,则温度为______(选填“升高” 或“降低”)逆反应是____________(选填“吸”或“放”)热反应。
(5)反应至5min时,若也只改变了某一个条件,使曲线发生如图所示变化,该条件可能是下述中的_________________。
| A.增加了C | B.增加了水蒸气 | C.降低了温度 | D.增加了压强 |
1
2
3
4
5
6
7
8
C
D
D
D
C
B
B
D
9
10
11
12
13
14
D
BC
BC
B
AB
CD
15.(10分) (1)① 氟离子 结构示意图 (1分)
② 取形状大小相同的镁片和铝片分别与体积相同、浓度相同的稀盐酸反应,观察产生气泡的快慢 (2分)(操作1分,观察指标1分。着重号部分缺一处扣1分。用金属与沸水反应、等浓度盐溶液碱性比较等合理方法均得分,方案无可行性不给分。)
③ Na2SO3 + SO2 + H2O = 2NaHSO3 (2分)(化学式错得0分,配平错扣1分)
有白色胶状沉淀生成,有无色刺激性气味气体产生 (2分)
(各占1分,着重号部分有缺漏合扣1分)
(2)① H2PO4-、HCO3-、HPO42- (2分) ② 强 (1分)
16.(11分)(1)除去表面的油污 CO32- + H2O  HCO3- + OH- (2分)
HCO3- + OH- (2分)
(2)不再有气泡产生(或只有极少量气泡产生) (1分)
(3)若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全
(两个方面各占1分)
(4)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O (2分) (化学式错得0分,配平错扣1分)
(5)6.6 (2分) (多写单位g不扣分)
(6)循环使用 (2分(具体说出如何循环使用同样得分,意思相近表达欠清晰扣1分)
17.(11分)
(1)2MnO4- +
5H
(化学式错得0分,配平错扣1分,漏↑扣1分,扣完为止)
(2)4 (2分)
(3)① 反应开始时:c(KMnO4)= =0.00067 mol?L-1 (1分)
=0.00067 mol?L-1 (1分)
反应时间: =
= =6.7min (1分)
=6.7min (1分)
KMnO4的平均反应速率:
ν(KMnO4)= =
= =1×10-4 mol?L-1?min-1 (1分)
=1×10-4 mol?L-1?min-1 (1分)
(一步完成计算且结果正确得3分,结果错误得0分。速率单位错误扣1分)
② 否(或:不可行) (1分) 取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。(3分)
(基本思路错误得0分,思路正确未强调草酸过量扣1分,未强调体积相同扣1分)
18


19.(12分)(1)增大 (1分)(2)不移动 (1分)(3)(4分)(各占2分,起点位置、曲线走势、终点与原曲线的相对高低等只要有一处错误则得0分。)
(4)(4分)0.60(2分) ν正_>_ν逆(2分)
(5)-787.0 (2分)(不带负号得0分,有效数字不准确扣1分。)
20.(每空2分,共10分)
(1) (2分) (2)均为氧化还原反应 (2分)
(2分) (2)均为氧化还原反应 (2分)
(3)3Fe+ 4H2O  Fe 3O4+4H2↑
(2分)
Fe 3O4+4H2↑
(2分)
(4)Fe+6H++3NO3-=Fe3++3NO2↑+3 H2O
3 Fe+8H++2NO3-=3Fe2++2NO ↑+4H2O (共2分)
(5)取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质 (2分)
21(1)a、d(1分); (2)3:2:3(1分); (3)C3H4O4(1分);


 (4)
+ CH2(COOH) 2
+H2O(2分)
(4)
+ CH2(COOH) 2
+H2O(2分)
(5)4种 (2分) (写出下列四种结构中的任意一种均可得2分)
 |
22.(10分)(1) C F (2分) (漏选1个扣1分,多选一个也扣1分,扣完为止。)
(2)① 3 (1分) 2 (1分)
② HCO3-中含有O-H键,相互之间可通过O-H┅O氢键缔合(1分)
(写出HCO3-化学式并指出离子之间有氢键作用才能得分)
(3)断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol, 断裂一个π键CO比N2更容易,所以CO更活泼。(2分)
 (叙述清楚,未具体计算出数值不扣分。)
(叙述清楚,未具体计算出数值不扣分。)
(4)① 1s22s22p63s23p63d84s2 (1分)
② 分子晶体 (1分)
③ (1分)
23.(10分) (1)FeC2O4?2H2O FeC2O4+2H2O,加热 减少的质量等于所含结晶水的质量 (2)FeO、CO、CO2;1:1:1。(3)30%。(4)6Fe2O3
FeC2O4+2H2O,加热 减少的质量等于所含结晶水的质量 (2)FeO、CO、CO2;1:1:1。(3)30%。(4)6Fe2O3 4Fe3O4+O2↑
4Fe3O4+O2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com