
题目列表(包括答案和解析)
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.8 | 5.2 |

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
(1)H2 (2)CO (3)CO和H2 (4)HCOOCH3 (5)HOOC—COOH
A.全部 B.仅(4)(5) C.(1)(2)(3) D.除(5)以外
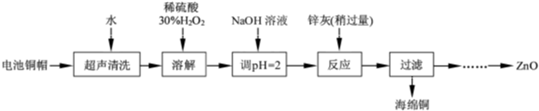
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
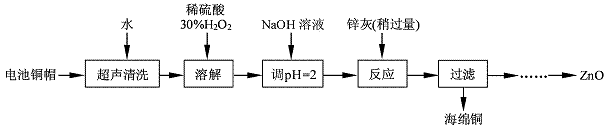
(1)①铜帽溶解时加入H2O2 的目的是 (用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的H2O2 除去。除去H2O2 的简便方法是 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O32- +I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②若滴定前溶液中的H2O2 没有除尽,所测定的Cu2+含量将会 (填“偏高”、“偏低”或“不变”)。
(3)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Zn2+ | 5. 9 | 8. 9 |
实验中可选用的试剂:30%H2O2、1. 0 mol·L-1HNO3、1. 0 mol·L-1NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:① ;② ;③过滤;④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com