
题目列表(包括答案和解析)
(15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程: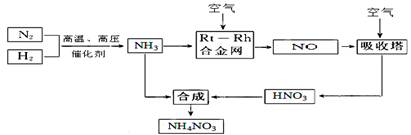
回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)="2.0" × 10-5 mol·L-1)。
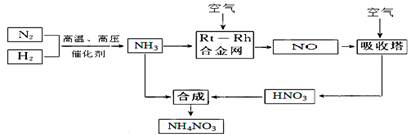
(15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程:

回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)=2.0 × 10-5 mol·L-1)。
| ||
| ||
测定银铜合金的成分,将30 g合金溶于80 mL 13.5 mol/L的浓硝酸中,完全溶解后,收集气体6.72 L(换算成标准状况且不考虑N2O4),并测得溶液的PH=0,设溶液体积不变,仍为80 mL,计算(只在答题纸上填结果)
(1)被还原的硝酸物质的量
(2)合金中银的质量分数
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意)
1.A 2.A 3.B 4.C 5.A 6.C 7.B 8.C 9.A 10.C
11.D 12.C 13.D 14.C
二、第Ⅱ卷 (非选择题,共58分)
15.(共6分)
I.AB(2分,答对1个1分,多选、错选为0分)
Ⅱ.①浓氨水、CaO固体(NaOH固体)(2分)
②BD(2分,答对1个1分,多选、错选为0分) ③C(2分)
16.(共14分)
(1)0.008mol(2分); 268.8(2分);
(2)①A(1分),因为A装置可以通N2将装置中的空气排尽,防止NO被空气中O2氧化(2分) ②123547(2分)(注: 1547考虑也给分) ③升高(1分)
(3)有(2分) 因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0)(2分)
17.(共8分)(1)碳 氧(各1分,共2分)
 (2)酸(1分)
NH
(2)酸(1分)
NH +H2O NH3?H2O+H+(2分)
+H2O NH3?H2O+H+(2分)
(3)①c(NH ) c(NO
) c(NO )(共2分,顺序颠倒为0分)②c(NO
)(共2分,顺序颠倒为0分)②c(NO )(1分)
)(1分)
18.(共8分)(1)Fe (1分); (2)FeCl2 (1分); Al2O3 (1分)。
(3) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分);
4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分); (4) ③ (1分)
19.(共12分)  I、-74.34 KJ ?mol-1 (2分)
I、-74.34 KJ ?mol-1 (2分)
Ⅱ、(1)< (1分)
(2)6 ; < ; = ; c(Na+)+c(H+)=c(X―)+c(OH―)(以上每空1分,共4分)
 (3)碱;X―+H2O HX+OH―(以上每空1分,共2分)
(3)碱;X―+H2O HX+OH―(以上每空1分,共2分)
(4) > (1分); 9:2(2分)
20.(共10分)(1)0.025 mol/(L?min) (2分)
(2)c2(NH3)/c3(H2)×c(N2) (2分)
(3)a、c (2分,答对1个1分,多选、错选为0分)
(4)向正反应方向(1分);不变(1分)
|