
题目列表(包括答案和解析)
 则1mol C与反应生成CO的反应热△H为
则1mol C与反应生成CO的反应热△H为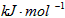
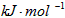
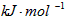
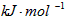
1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知每摩单质碳完全燃烧生成CO2放出热量为Y kJ,则1mol C与O2反应生成CO的反应热△H为
A.-Y kJ/mol B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol
1840年,俄国化学家盖斯(G.H.Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ?mol-1,则1 mol C与O2反应生成CO的反应热ΔH为 ( )
A.-Y kJ?mol-1 B.-(10X-Y)kJ?mol-1
C.-(5X-0.5Y) kJ?mol-1 D.+(10X-Y) kJ?mol-1
A.-Y kJ·mol-1 B.-(10X-Y)kJ·mol-1
C.-(5X-0.5Y) kJ·mol-1 D.+(10X-Y) kJ·mol-1
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意)
1.A 2.A 3.B 4.C 5.A 6.C 7.B 8.C 9.A 10.C
11.D 12.C 13.D 14.C
二、第Ⅱ卷 (非选择题,共58分)
15.(共6分)
I.AB(2分,答对1个1分,多选、错选为0分)
Ⅱ.①浓氨水、CaO固体(NaOH固体)(2分)
②BD(2分,答对1个1分,多选、错选为0分) ③C(2分)
16.(共14分)
(1)0.008mol(2分); 268.8(2分);
(2)①A(1分),因为A装置可以通N2将装置中的空气排尽,防止NO被空气中O2氧化(2分) ②123547(2分)(注: 1547考虑也给分) ③升高(1分)
(3)有(2分) 因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0)(2分)
17.(共8分)(1)碳 氧(各1分,共2分)
 (2)酸(1分)
NH
(2)酸(1分)
NH +H2O NH3?H2O+H+(2分)
+H2O NH3?H2O+H+(2分)
(3)①c(NH ) c(NO
) c(NO )(共2分,顺序颠倒为0分)②c(NO
)(共2分,顺序颠倒为0分)②c(NO )(1分)
)(1分)
18.(共8分)(1)Fe (1分); (2)FeCl2 (1分); Al2O3 (1分)。
(3) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分);
4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分); (4) ③ (1分)
19.(共12分)  I、-74.34 KJ ?mol-1 (2分)
I、-74.34 KJ ?mol-1 (2分)
Ⅱ、(1)< (1分)
(2)6 ; < ; = ; c(Na+)+c(H+)=c(X―)+c(OH―)(以上每空1分,共4分)
 (3)碱;X―+H2O HX+OH―(以上每空1分,共2分)
(3)碱;X―+H2O HX+OH―(以上每空1分,共2分)
(4) > (1分); 9:2(2分)
20.(共10分)(1)0.025 mol/(L?min) (2分)
(2)c2(NH3)/c3(H2)×c(N2) (2分)
(3)a、c (2分,答对1个1分,多选、错选为0分)
(4)向正反应方向(1分);不变(1分)
|