
题目列表(包括答案和解析)
在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3 ΔH<0.反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0.反应中NH3的物质的量浓度的变化情况如图所示:

(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________.
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________(填“增大”、“减小”或“不变”).
(3)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L).请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线.
在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:

(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为________.
(2)该反应达到平衡时H2的转化率________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为________.(填序号)
a、0.20 mol·L-1
b、0.12 mol·L-1
c、0.10 mol·L-1
d、0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时NH3的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(N2)、n(H2)、n(NH3)分别为a、b、c,则a、b、c之间应该满足的关系式为:________
(6)若该反应在298 K、398 K时的化学平衡常数分别为K1、K2,则K1________K2(填“>”“=”或“<”).
 2NH3(g) ΔH<0 反应中NH3的物质的量浓度的变化的情况如图所示:
2NH3(g) ΔH<0 反应中NH3的物质的量浓度的变化的情况如图所示: 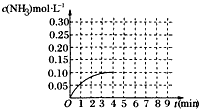
(10分)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为______________.
(2)该反应达到平衡时H2的转化率________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为____________.(填序号)
A、0.20 mol·L-1 b、0.12 mol·L-1 c、0.10 mol·L-1 d、0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时NH3的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(N2)、n(H2)、n(NH3)分别为a、b、c,则a、b、c之间应该满足的关系式为:
(6)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “=” 或 “<” )。
(10分)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: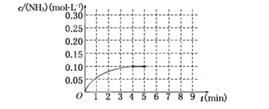
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为______________.
(2)该反应达到平衡时H2的转化率________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为____________.(填序号)
A、0.20 mol·L-1 b、0.12 mol·L-1 c、0.10 mol·L-1 d、0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时NH3的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(N2)、n(H2)、n(NH3)分别为a、b、c,则a、b、c之间应该满足的关系式为:
(6)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “="”" 或 “<” )。
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意)
1.A 2.A 3.B 4.C 5.A 6.C 7.B 8.C 9.A 10.C
11.D 12.C 13.D 14.C
二、第Ⅱ卷 (非选择题,共58分)
15.(共6分)
I.AB(2分,答对1个1分,多选、错选为0分)
Ⅱ.①浓氨水、CaO固体(NaOH固体)(2分)
②BD(2分,答对1个1分,多选、错选为0分) ③C(2分)
16.(共14分)
(1)0.008mol(2分); 268.8(2分);
(2)①A(1分),因为A装置可以通N2将装置中的空气排尽,防止NO被空气中O2氧化(2分) ②123547(2分)(注: 1547考虑也给分) ③升高(1分)
(3)有(2分) 因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0)(2分)
17.(共8分)(1)碳 氧(各1分,共2分)
 (2)酸(1分)
NH
(2)酸(1分)
NH +H2O NH3?H2O+H+(2分)
+H2O NH3?H2O+H+(2分)
(3)①c(NH ) c(NO
) c(NO )(共2分,顺序颠倒为0分)②c(NO
)(共2分,顺序颠倒为0分)②c(NO )(1分)
)(1分)
18.(共8分)(1)Fe (1分); (2)FeCl2 (1分); Al2O3 (1分)。
(3) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分);
4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分); (4) ③ (1分)
19.(共12分)  I、-74.34 KJ ?mol-1 (2分)
I、-74.34 KJ ?mol-1 (2分)
Ⅱ、(1)< (1分)
(2)6 ; < ; = ; c(Na+)+c(H+)=c(X―)+c(OH―)(以上每空1分,共4分)
 (3)碱;X―+H2O HX+OH―(以上每空1分,共2分)
(3)碱;X―+H2O HX+OH―(以上每空1分,共2分)
(4) > (1分); 9:2(2分)
20.(共10分)(1)0.025 mol/(L?min) (2分)
(2)c2(NH3)/c3(H2)×c(N2) (2分)
(3)a、c (2分,答对1个1分,多选、错选为0分)
(4)向正反应方向(1分);不变(1分)
|