请回答:(1)写出试剂A.B.C的化学式:A .B .C ,(2)写出操作D的名称:D ,(3)写出回收物①.②和G的组成:① .② .G . 【
查看更多】
题目列表(包括答案和解析)
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
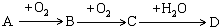
请回答下列问题:
(1)若常温下A为淡黄色固体单质,D为强酸,则A、D分别为(填写化学式)A:
S
S
,D:
H2SO4
H2SO4
.写出D→B的化学方程式:
Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O
Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O
.
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红.则A为
NH3
NH3
,写出A→B转化的化学方程式:
.
查看答案和解析>>
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料.它们的结构简式如下所示:

请回答下列问题:
(1)用A、B、C、D填空:
既能使FeCl
3溶液显色又能和NaHCO
3溶液反应放出气体的有
D
D
.
(2)1molB最多能与
4
4
molBr
2发生反应.
(3)按下图C经一步反应可生成E,E是B的同分异构体.
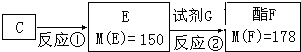
①E到F转化过程中除用到催化剂外,还用到一种试剂G是
CH3CH2OH
CH3CH2OH
(写结构简式)
②写出反应①的化学方程式:
2C
6H
5CH
2CH
2CHO+O
22C
6H
5CH
2CH
2COOH
2C
6H
5CH
2CH
2CHO+O
22C
6H
5CH
2CH
2COOH
.
(4)写出D与NaHCO
3溶液发生反应的化学方程式:
.
查看答案和解析>>
A、B、C、D、E都是前20号元素中的常见元素,且核电荷数递增.A原子没有中子;B原子次外层电子数与最外层电子数之差等于电子层数;C元素是地壳中含量最高的元素;4.6g D单质与足量盐酸作用可产生2.24LH
2(标准状态下);E的一价阴离子的核外电子排布与Ar的核外电子排布相同.请回答下列问题:
(1)写出A、B、D的元素符号:A
H
H
;B
C
C
;D
Na
Na
.
(2)C离子的电子式
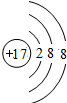
;E的离子结构示意图
.
(3)实验室里检验E的单质常用的试剂是
淀粉KI溶液(或试纸)
淀粉KI溶液(或试纸)
.
(4)写出电解D、E形成化合物的水溶液的化学反应方程式
.
(5)写出由A、B、C、D形成的化合物与由A、C、E形成的化合物发生反应的化学反应方程式
HClO4+NaHCO3=NaClO4+H2O+CO2↑
HClO4+NaHCO3=NaClO4+H2O+CO2↑
.
查看答案和解析>>
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,X、Y是生活中常见的金属单质,相关物质间的关系如下图所示.

请回答下列问题:
(1)写出X与A反应的化学方程式:
.
(2)若试剂1是NaOH溶液,写出X与试剂1反应的离子方程式
2Al+2H2O+2OH-═2AlO2-+3H2↑
2Al+2H2O+2OH-═2AlO2-+3H2↑
.
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是
取少量溶液于试管中,滴加几滴KSCN溶液不变色,滴加氯水后溶液变红色,则证明原溶液中含有Fe2+
取少量溶液于试管中,滴加几滴KSCN溶液不变色,滴加氯水后溶液变红色,则证明原溶液中含有Fe2+
.
②将物质C溶于水,其溶液呈酸性,原因是
Al
3++3H
2O

Al(OH)
3+3H
+Al
3++3H
2O

Al(OH)
3+3H
+ (用离子方程式表示).
③某高效净水剂是由Y(OH)SO
4聚合得到的.工业上以D、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO
4,反应中有NO生成,该反应的化学方程式是
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
.
(4)若试剂1和试剂2均是稀盐酸,将C与D混合后,通入气体Z,再滴加氢氧化钠溶液调节溶液的pH,可水解聚合得到高效净水剂聚合氯化铝铁[AlFe(OH)
nCl
6-n]
m.气体Z是
氯气
氯气
,其作用是
亚铁离子氧化为铁离子
亚铁离子氧化为铁离子
.
查看答案和解析>>
A、B、C、D、E五种短周期元素,已知:
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数
;
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式:
(2)C
2A
4?H
2O与NH
3?H
2O相似,水溶液也呈弱碱性,用化学用语表示其水溶液呈弱碱性的原因:
;
(3)B、D、E三元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化.当a mol Y转化成a mol X时:(溶液中进行)
①若加入a mol 纯净物Z就可实现转化,则加入Z为:
(填一种Z物质名称)
②若加入0.5a mol 纯净物Z就可实现转化,则加入Z为:
(填一种Z物质化学式)
(4)C
2A
4可用作高能燃料电池的燃料,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极方程式:
;
用该电池电解含0.25mol CuSO
4和0.5mol NaCl混合溶液,当电池消耗10.4g C
2A
4时,则两电极生成的气体共
mol.
查看答案和解析>>
题号
1
2
3
4
5
6
7
8
答案
C
C
D
D
D
B
D
D
题号
9
10
11
12
13
14
|
答案 C BD D C BC AC |
15.(8分)(1)Na2CO3(或NaOH) CO2 稀H2SO4
(2)分馏 (3)二氯甲烷 乙醇 苯酚钠、乙酸钠
16.(12分)(1)(NH4)2SO4
(2)NH4++OH-
= ==NH3↑+H2O
2NH3+4H3BO3=2NH4++B4O72―+5H2O
==NH3↑+H2O
2NH3+4H3BO3=2NH4++B4O72―+5H2O
(3)①C3H6N6 66.7% ② 18.8 g
17.(8分)(1)
C8H8
其他答案不得分。
(2)
A的结构简式:
 或
或
写成 或键线式
或键线式 也得分;苯环画成
也得分;苯环画成 也可,其他答案不得分。
也可,其他答案不得分。
B的结构简式:

写成键线式 也得分;其他答案不得分。
也得分;其他答案不得分。
C的结构简式:

写成 , 或写成键线式
, 或写成键线式 ,其他答案不得分。
,其他答案不得分。
18.(14分)(1) C8H8O2
(2) A的结构简式:
 或
或 
若写成C6H5COOCH3也得分。
B的结构简式:
 或
或 
若写成C6H5CH2OCHO也得分。
C的结构简式:
 或
或 
若写成C6H5OCOCH3也得分。
D的结构简式:
 或
或 
若写成C6H5CH2COOH也得分。
(3) A与NaOH溶液发生了酯的碱性水解反应。
答碱性水解反应、酯的水解反应或水解反应、取代反应也得分。
D与NaOH溶液发生了酸碱中和反应。
答酸碱反应或中和反应也得分;其他答案不得分。
(4) 
19.(10分)(1)甲、乙、丙 (2)醛基、羟基
(3) ①消去
 ②
② 
③
20.(12分)

21.(8分)(1)设生成的气体中,CO2 的分数为x
44x
+18(1-x)=28.4
x=0.4
反应后的混合气体中,CO2 与水蒸气的体积比为 0.4∶(1-0.4)=2∶3
(2)CH4 CH2O2 1∶1
CH4O CH2O 1∶1
(3)CH3OH HCHO
 w
w
江苏省2009届高三化学各地名校月考试题汇编:
有机化学基础(3)
(江苏省赣榆高级中学2008-2009学年度上学《有机化学基础》综合小练习2)
一、选择题:(本题包括8小题,每题只有1个选项符合题意,每小题 4分,共32分)
1.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是
A.CH3-CH=CH-CHO
B.CH3- -
- -CH3
-CH3
C.HOCH2-CH2-CH=CH-CHO D.HOCH2- -CH2-CHO
-CH2-CHO
 2.胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:
2.胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:
①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它的部分同分异构体能发生银镜反应;④1mol该化合物最多可与2 molBr2发生反应。其中正确的是
A.①③ B.①②④ C.②③ D.②③④
3.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
混合物
试剂
分离方法
A
苯(苯酚)
溴水
过滤
B
甲烷(乙烯)
酸性高锰酸钾溶液
洗气
C
乙酸乙酯(乙酸)
氢氧化钠溶液
蒸馏
D
溴乙烷(乙醇)
蒸馏水
分液
4.可以把5种无色溶液:乙醇、苯酚、AgNO3、KOH、氢硫酸一一区分的试剂是
A.新制碱性Cu(OH)2悬浊液 B.FeCl3溶液
C.BaCl2溶液 D.酸性KMnO4溶液
5.下列有机物是 的同系物的是
的同系物的是
A. B.
B. C.
C. D.
D.
6.11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68LCO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为
A.20% B.40% C.60% D.80%
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
7.有机物的结构简式如下图:则此有机物可发生的反应类型有
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和
 A.①②③⑤⑥
A.①②③⑤⑥
B.②③④⑤⑥
C.①②③④⑤⑥⑦
D.②③④⑤⑥⑦
8.总质量一定时,不论以任何比例混合,完全燃烧生成CO2与H2O的量为定值的是
A. 和C2H4 B.C2H4和C3H8
和C2H4 B.C2H4和C3H8
C.CH2O和C2H4O2 D.C3H8O和C2H6O
二、选择题:(本题包括7小题,每题有1-2个选项符合题意,每小题 4分,共28分)
9.等质量的丙醛、丙醇、丙烷、丙烯完全燃烧时,消耗氧气最多的是
A.丙醛 B.丙醇 C.丙烷
D.丙烯
10.下列叙述正确的是
A.丙烷分子中3个碳原子一定在同一条直线上
B.甲苯分子中7个碳原子都在同一平面上
C.乙烷分了中碳原子和全部氢原子都在同一平面上
D.2-丁烯分子中4个碳原子有可能在同一条直线上

11.白藜芦醇
广泛存在于食物中,它可能具有抗癌性。能
够跟1mol该化合物起反应的Br2或H2的最大用量分别是
A.1mol、1mol B.3.5mol、7mol C.3.5mol、6mol D.6mol、7mol
12.某一元醛发生银镜反应,可得21.6g银,等物质的量的该醛完全燃烧时,可生成5.4g水,则该醛可能是
A.乙醛 B.丙醛 C.丁醛 D.丁烯醛(CH2=CH-CH2-CHO)
13.毒品一直影响社会安定。吗啡与海洛因都是被严格查禁的毒品,已知吗啡的分子式是
C17H19NO3,海洛因是吗啡的二乙酸酯,则海洛因的分子式是
A.C21H23NO3 B.C21H22NO5 C.C21H23NO5 D.C21H27NO7
w.w.w.k.s.5.u.c.o.m
14.燃烧下列混合气体,所产生的二氧化碳的量一定小于燃烧相同质量丙烯所产生的二氧化碳的是
A.乙烯、丙烷 B.乙炔、乙烯 C.乙炔、丙烷 D.乙烷、环丙烷
 15.中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1
mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为
15.中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1
mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为
A.2
mol Br2 2 mol NaOH B.
2 mol Br2 3 mol NaOH
C.3
mol Br2 4 mol NaOH D.4
mol Br2 4 mol NaOH
请把上述符合题意的选项的序号填入下表中
班级
姓名 成绩
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
三、填空题(本题包括两个小题,共19分)
16.(9分)烷烃分子中,与碳原子相结合的氢原子有3个、2个、1个等不同情况,分别用伯氢、仲氢、叔氢加以区别,如下式表示:
|
|
|
|
|

在烷烃的取代反应中,伯、仲、叔三种氢原子被取代的机率(机会)不同,但同类氢原子被取代的机率(机会)可视为相同。现将n mol 2―甲基丁烷与适量溴蒸气在一定条件下完全反应,若只生成四种一溴代物和溴化氢。 (1)反应中生成溴化氢的物质的量为
mol; (2)将反应生成的四种一溴代物的混合物充分燃烧,生成H2O、CO2和HBr,此时需消耗氧气
mol; (3)若上述溴的取代反应中,伯、仲、叔氢原子被溴原子取代的几率比为a:b:c,则生成的
CH3 
四种一溴代物中,CH3―CH2―CH―CH2Br所占的物质的量分数为 。 17.(10分)有机化合物A、B的分子式不同,它们组成中的成分元素只能是碳、氢、氧元素中的两种或三种。若A、B不论以何种比例混合,只要物质的量之和不变,则完全燃烧时消耗氧气和生成水的物质的量也不变。 (1)此时,有机化合物必须满足的条件是_ (2)如果A是甲烷,则符合上述条件的有机化合物B中,相对分子质量
最小的B有机化合物的分子式为_
_,并写出相对分子质量最小的有机化合物B的三种同分异构体的结构简式_
__、_ 、 __
__。 四、计算题(本题包括两个小题,共21分) 18.(8分)某工业反应混合液中仅可能含有的组分是:乙醚( )、乙醇和水,经分 )、乙醇和水,经分 析,液体中C、H、O的原子数之比16:42:5。 (1)若混合液中只含2种组分,则所有可能的组合是:
。 w.w.w.k.s.5.u.c.o.m (2)若混合液中含有3种组分,在628g混合液中有  ,此时乙醇和乙醚的物质的 ,此时乙醇和乙醚的物质的 量各是多少? 19.(13分)工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况: 表一:原料、反应条件、平衡转化率、日产量 乙炔水化法 乙烯氧化法 原料 乙炔、水 乙烯、空气 反应条件 HgSO4、100~125℃ PdCl2-CuCl2、100~125℃ 平衡转化率 乙炔平衡转化率90%左右 乙烯平衡转化率80%左右 日产量 2.5吨(某设备条件下) 3.6吨(相同设备条件下) 表二:原料来源生产工艺 原料生产工艺过程 乙炔 
乙烯 来源于石油裂解气 根据上述两表,回答下列问题: (1)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因。  w.w.w.k.s.5.u.c.o.m w.w.w.k.s.5.u.c.o.m
(2)若乙烯由石油裂化(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40mol乙烯,求:能够得到丁二烯和氢气的物质的量各为多少?  w.w.w.k.s.5.u.c.o.m w.w.w.k.s.5.u.c.o.m
江苏省赣榆高级中学2008-2009学年度上学期 《有机化学基础》综合小练习之二参考答案 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 C C D B B B C C C B D BD C AD C 16.(1)n; (2)7.5n(提示:四种一溴代物中有c n mol,有11nmol,除去nmol H在HBr中之外,其余C均在CO2中,H均在H2O中) (3) 。(提示:伯氢共有9个,仲氢共有2个,叔氢只有1个,而3个甲基中有2个甲基连在同一个碳原子上,这样甲基上的氢原子共有6个) 。(提示:伯氢共有9个,仲氢共有2个,叔氢只有1个,而3个甲基中有2个甲基连在同一个碳原子上,这样甲基上的氢原子共有6个) 17.(1)分子中氢原子个数相等,且分子组成中相差CO2的整数倍 (2)C2H4O2 CH3COOH HCOOCH3 HOCH2CHO 18.(1)略(2)2:7 19.(1)从表一来看,两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多。 从表二来看,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,较难获得;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得。 (2)要得到40molC2H4,则会生成5molCH4、10molC3H6。设生成x mol丁二烯(C4H6)和y molH2,且需要催化裂解a mol的CnHm。 则:根据碳原子守恒:an=5+30+80+4x=115+4 x 根据氢原子守恒:am=20+60+160+6x+2y=240+6x+2y 根据题意:x+y=100-55 解得:x= 或x= 或x= ―28.75 ―28.75 y= 或y=73.75― 或y=73.75―
| |




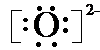
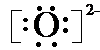


 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+ ==NH3↑+H2O
2NH3+4H3BO3=2NH4++B4O72―+5H2O
==NH3↑+H2O
2NH3+4H3BO3=2NH4++B4O72―+5H2O  或
或
 或键线式
或键线式 也得分;苯环画成
也得分;苯环画成 也可,其他答案不得分。
也可,其他答案不得分。
 也得分;其他答案不得分。
也得分;其他答案不得分。 
 , 或写成键线式
, 或写成键线式 ,其他答案不得分。
,其他答案不得分。 或
或 
 或
或 
 或
或 
 或
或 

 ②
② 

 w
w -
- -CH
-CH -CH2-CHO
-CH2-CHO 2.胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:
2.胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法: 的同系物的是
的同系物的是 B.
B. C.
C. D.
D.
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m A.①②③⑤⑥
A.①②③⑤⑥  和C2H4 B.C2H4和C3H8
和C2H4 B.C2H4和C3H8 
 15.中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1
mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为
15.中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1
mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为