
题目列表(包括答案和解析)
| A.燃料的燃烧反应都是放热反应 |
| B.绿色植物进行光合作用时,能把光能转化为化学能 |
| C.分子的热稳定性主要取决于分子内化学键的键能大小,与分子间作用力无关 |
| D.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,则说明相同条件下,在密闭容器中,1molN2和3molH2混合充分反应后放热92.4kJ |
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
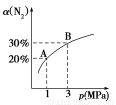
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
 2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )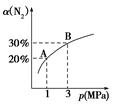
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
| ||
| △ |
| [NO]4[H2O]6 |
| [NH3]4[O2]5 |
| [NO]4[H2O]6 |
| [NH3]4[O2]5 |
一、选择题:
1.B 2.A 3.C 4.B 5.D 6.B 7.B 8.C 9.A 10.B 11.A 12.C
二、选择题:
13.B  14.BC 15.B 16.C.17.AD 18.BC 19.AB 20.C
14.BC 15.B 16.C.17.AD 18.BC 19.AB 20.C
三、
21.B C D E
22.⑴K2CO3 、AlCl3、BaCl2;
⑵产生白色沉淀,后沉淀逐渐溶解;
⑶①中;②Ba2++OH-+H++SO2- 4=BaSO4↓+H2O;③13
四、
23.本题答案有开放性,合理即可给分。
⑴①C(或Fe) ②
⑶①CaC2+2H2O=Ca(OH)2+C2H2↑ ;②麦芽糖;
⑷①Na2CO3+CO2+H2O=2NaHCO3 ;②红褐色固体。
24.
编号
1
2
3
4
5
X的化学式
Na
Na2O
Na2O2
NaOH
NaH
加入X的质量(g)
4.6
6.2
7.8
8.0
4.8
五、
25.(1)醛基;略(为羧基的结构式);
(2)氧化反应;酯化反应;

 (3)
(4)
(3)
(4)

六、
26.

(0, 0.7) (0.1, 0.4) (0.2, 0.3) (0.3, 0.4) (0.4, 0.7) (0.5, 0.7)
(每1折点1分,离子方程式每个1分)
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com