
题目列表(包括答案和解析)
甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇。
(1)已知在常温常压下:

(2)工业上正在研究利用来生产甲醇燃料的方法,该反应为:

在某温度下,将6mol CO2和8molH2 充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%。请回答:
②用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH)=____.
②此温度下该反应平衡常数K=____________ mol;
mol;
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后H2的转化率____________75% (填“大于”、“小于”或“等于”)。
(3)一氧化碳与氢气也可以合成甲醇:
①若该反应在恒温恒容条件下进行,下列说法正确的是____;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50L2/mol2,反应到某时刻测得各组分的物质的量如下:

请比较此时正、逆反应速率的大小: (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
钛是一种活泼金属,具有密度小、熔点高、可塑性强、机械强度高等性能。工业上常用硫酸分解铁钛矿石来制备二氧化钛,用以冶炼钛,主要有以下五个反应:
①FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
②TiOSO4+2H2O=H2TiO3↓+H2SO4
③H2TiO3 TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2 TiCl4↑+2CO↑
TiCl4↑+2CO↑
⑤TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
(1)针对以上五个反应,下列叙述错误的是________。
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表现了金属镁比金属钛的还原性强
(2)钛具有很强的耐腐蚀性,以下对其原因的分析正确的是________。
A.钛是像金、铂一样的不活泼金属
B.金属钛的表面易形成致密的氧化膜
C.钛与氧气、酸等腐蚀剂不反应
D.钛有很高的强度
甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇。
(1)已知在常温常压下: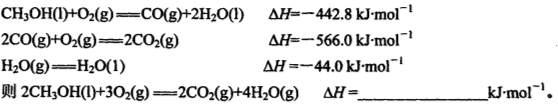
(2)工业上正在研究利用来生产甲醇燃料的方法,该反应为: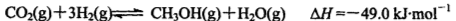
在某温度下,将6mol CO2和8molH2充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%。请回答:
②用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH)=____.
②此温度下该反应平衡常数K=____________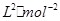 mol;
mol;
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后H2的转化率____________75% (填“大于”、“小于”或“等于”)。
(3)一氧化碳与氢气也可以合成甲醇: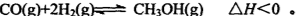
①若该反应在恒温恒容条件下进行,下列说法正确的是____;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50L2/mol2,反应到某时刻测得各组分的物质的量如下:
请比较此时正、逆反应速率的大小: (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
 TiO2+H2O
TiO2+H2O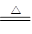 TiCl4↑+2CO↑
TiCl4↑+2CO↑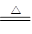 2MgCl2+Ti
2MgCl2+Ti

 mol;
mol;

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)一、选择题(本题包括21小题,每小题2分,共42分。)
1.D 2.C 3.C 4.D 5.C 6.C 7.D 8 .D 9.C 10.C
11.B 12.C 13.C 14.C 15.D 16.C 17.B 18.D 19.B 20.A二、本题包括1小题,共12分。
21.(12分)
(1)B中装无水硫酸铜,检验水蒸气;C中装澄清的石灰水,检验二氧化碳;(每空1分)
(2)验纯后点燃E处的气体,火焰呈蓝色。(2分,不答“验纯”扣1分)
(3)点燃前应验纯;CO有毒,实验要通风;加热时要均匀受热等。(2分)
(4)挥发出来的草酸蒸气与石灰水反应生成了草酸钙沉淀,会干扰 的检验(2分)
的检验(2分)
在装置B和C装置间增加―个装有水(或烧碱溶液)的洗气装置(2分)
三、本题包括3小题,共38分。
22.(每空2分,共12分)
(1)
 (2) >
(2) >
(3)
(4) (5) 336
(5) 336
23.(每空2分,共12分)
(1)A:Si B:Mg (2)抑制氯化镁水解
(3) ①
③
④
24.(每空2分,共14分)
(1) (2)
(2)
(3) 负极反应产物
负极反应产物
(4)①
②
③
四、本题包括1小题,共10分。
25.(1) (2分)
(2分)
 (2分)
(2分)
(2)解:设生成 的物质的量为
的物质的量为 。由上述方程式知:
。由上述方程式知:






生成 的质量为:
的质量为: (2分)
(2分)
(3)①5、1、8、1、5、4 (2分) ②83.33% (2分)
(2分) ②83.33% (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com