
题目列表(包括答案和解析)
以下措施与其目的对应不正确的是
A.植树造林——缓和温室效应
B.限制和合理使用塑料购物袋——减少白色污染
C.以绿色制冷剂代替氟利昂——保护臭氧层
D.将地下输油钢管与外加电源的正极相连——保护钢管不被腐蚀
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程。
(一)结构分析
(1)写出乙醇的结构式 ;官能团的电子式 。
(二)性质预测
(2)对比乙醇和乙烷的结构,经过讨论,同学们认为乙醇分子中氧原子吸引电子能力较强,预测在一定条件下分子中 键(填写具体共价键)容易发生断裂。为此,他们查阅了相关资料,获得了以下乙醇性质的部分事实。
|
下列关于乙醇结构和性质的分析、理解错误的是
A.-OH对-C2H5的影响使乙醇与钠的反应比水与钠的反应速率慢ks5u
B. 乙醇在浓硫酸催化下,170℃时脱水生成乙烯的反应为消去反应
C. 乙醇的核磁共振氢谱图上有3个吸收峰,其强度之比为3︰2︰1,与钠反应的是
吸收强度最小的氢原子
 D. 乙醇与甲醚互为官能团异构体
D. 乙醇与甲醚互为官能团异构体
(三)设计方案、进行实验
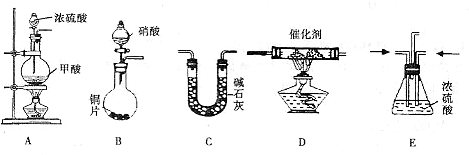
甲同学用4mL 95%的乙醇、8mL90%浓硫酸、
6g溴化钠研究乙醇转化为溴乙烷的反应。右图
是他设计的实验装置图(已省略部分夹持仪器)。
请回答有关问题。
(3)预计实验时装置Ⅰ主要发生两个反应,写出反应②的化学方程式。
![]() ①2NaBr + H2SO4 2HBr + Na2SO4,
①2NaBr + H2SO4 2HBr + Na2SO4,
②
(4)实验过程中,观察到反应后期烧瓶内液体颜色变棕黑,U形管右边与大气相通的导管口产生大量有刺激性气味的白雾,U形管内有少量淡黄色液体,该液体的有机成分是 。若要获得纯净的溴乙烷,方法是:实验结束后 。
(四)反思与改进
(5)乙同学认为:实验所用浓硫酸必须进行稀释,目的是 (填字母),稀释后的浓硫酸应放在 (填实验仪器名称)中。
A.减少HBr的挥发 B.防止浓硫酸分解产生SO2
C.减少副产物乙烯和乙醚的生成 D.减少Br2的生成
(6)丙同学提出应该对实验装置进行改进,请为两部分装置选择正确的措施:
A.不作改变 B.保留酒精灯加热,增加温度计且温度计水银球插入反应液中
C.水浴加热 D.冰水混合物冷却
装置Ⅰ ;装置Ⅱ 。请你再提出一条改进措施 。
| ||
| △ |
 ( )→( )→( )→收集气体
( )→( )→( )→收集气体| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
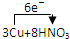 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2OI.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是 (填序号)。
A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中;
B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止;
C.在石油的分馏实验中,温度计需插入液体中;
D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
E用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值。
II.汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等。治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2。某小组在实验室利用下图所示装置模拟处理汽车尾气中CO和NOX的反应并测量反应后混合气体的组成。(已知 )
)

试回答下列问题:
(1)仪器的连接顺序为
(2)E装置的作用是___________________、___________________________________________。
(3)写出D中的NOX与CO反应的化学方程式______________________________________。
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________。
(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4)。则收集到的气体中NO的物质的量为___________________。
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:___________________________________________。
 CO↑+H2O)
CO↑+H2O)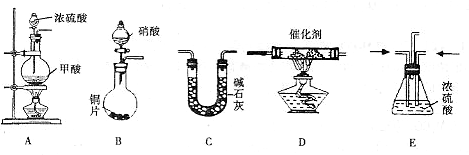
 →→→收集气体
→→→收集气体
生物部分
题号
1
2
3
4
5
6
答案
D
D
C
C
D
B
1.D 浒苔是一种绿藻,属于真核生物,有叶绿体能进行光合作用。其繁殖速度快,是由于农田污水、生活污水等大量流人海中,大量的N、P无机盐离子导致的富营养化。
2.D 突触之所以能发挥作用,是因为突触前膜释放递质,突触后膜有相应的受体识别。 有结构但没有传递功能,说明要么缺乏受体,要么缺乏相应的神经递质。
3.C 细胞全能性是指已经分化的细胞具有发育为完整个体的潜力,免疫细胞在机体内 既能参与细胞免疫,也参与体液免疫。浆细胞的功能是分泌抗体,不能识别抗原。
4.C 分析表中数据可知,DNA的含量、种类稳定,属于遗传物质;RNA为1000种,说明DNA中有很多的基因;除水外,蛋白质的含量和分子种类很多,说明蛋白质是生命活 动的主要承担者。
5.D “稻→萍→鱼”体现的主要是该生态系统内群落的垂直结构;该生态系统提高了能 量的利用率,但是不能大幅度提高营养级之间的能量传递效率;在弃耕农田上进行的群落演替为次生演替。
6.B 从图示分析,图A含有叶绿素,能进行光合作用中的光反应,为叶绿体的类囊体薄膜;图B中是进行的有氧呼吸的第三阶段,是在线粒体内膜上进行的,[H]主要来源于有氧呼吸第二阶段丙酮酸和水的分解。
30.(共19分)
I.(9分)
(1)②(1分)细胞质基质(1分)
(2)CO2浓度(2分)
(3)呼吸作用所释放的CO2量(1分) D(2分)
(4)从叶绿体基质向类囊体薄膜移动(1分) 在高温干旱的环境里,气孔关闭(1分)
Ⅱ.(每空2分,10分)
(1)探究X对酵母菌无氧呼吸的影响
(2)空白对照,探究无关变量对实验结果的影响
(3)①装置1、2中液滴不移动,装置3中液滴向右移动,说明X对酵母菌无氧呼吸有促进作用
② 装置1中液滴不移动,装置2、3中液滴向右移动距离相等,说明X对酵母菌无氧呼吸无影响
③ 装置l中液滴不移动,装置3中液滴向右移动距离小于装置2移动的距离,说明X对酵母菌无氧呼吸有抑制作用。
(4)探究温度(葡萄糖浓度、酵母菌数量)对酵母菌无氧呼吸的影响
31.(每空1分,共8分)
(1)不同蛋白质的相对分子质量大小不同 气泡会搅乱洗脱液中蛋白质的洗脱顺序,影响分离效果
(2)使红细胞吸水胀破
(3)碳源 氮源(答错顺序不给分)
(4)平板划线法 稀释涂布平板法(稀释混和平板法)(注:两种方法顺序可颠倒)灭菌
32.(共17分)
(1)相对性状明显,易于区分;后代数目多,统计结果更准确;雄蕊花序顶生,雌蕊果穗着生在中部,便于操作;既能自花传粉也能异花传粉(4分,任答两点即可,其他合理答案亦给分)
(2)显性(1分) 分别从子一代中各取出等量若干玉米种子,种植,杂交,观察其后代叶片性状,表现出的叶形为显性性状,未表现出的叶形为隐性性状(1分) 若后代只 表现一种叶形,该叶形为显性性状,另一种为隐性性状(1分);若后代既有常态叶又有皱叶,则不能做出显隐性判断(1分)
(3)选择样本太少,实验有一定的偶然性,不能代表全部子粒的基因型(1分)
实验思路:用该玉米穗上的全部子粒(或任意选取若干子粒)作为亲本,单独隔离种植 (自交),观察记录并分别统计子一代植株的高、矮。(2分,其他合理答案也给分,下同)
预期:① 若子一代全为高茎,说明该玉米穗上的子粒全是纯合子;(2分)
② 若所有种子的子一代既有高茎又有矮茎,说明该玉米穗上的子粒全为杂合子;(2分)
③ 若部分种子子一代全为高茎,另一部分种子子一代既有高茎又有矮茎,说明该玉米 穗上的子粒既有纯合子也有杂合子。(2分)
化 学 部 分
题号
7
8
9
10
11
12
13
答案
D
D
C
B
C
B
A
7.D KSCN、NH4SCN、NaSCN在溶液中完全电离,Fe 可与SCN
可与SCN 结合为硫氰合铁。
结合为硫氰合铁。
8.D 保护钢管不被腐蚀应将钢管与电源负极相连。
9.C X原子最外层电子数比次外层电子数少3,推知X为P,则R、Y、Z依次为O、S、C1。
10.B 反应②不是氧化还原反应,根据质量守恒 内物质应为Fe2O3,生成1mol Na2Cr2O7(反应①生成2 mol
Na2CrO4)时共转移7 mol电子。
内物质应为Fe2O3,生成1mol Na2Cr2O7(反应①生成2 mol
Na2CrO4)时共转移7 mol电子。
11.C 水玻璃易与空气中二氧化碳作用而变质;丙烯分子中含甲基,甲基为四面体结构, 不可能都在同一平面上;苯含碳量大于乙烯,因而在空气中燃烧产生的烟更浓;Li在空气中燃烧生成Li2O。
12.B 若两酸均为强酸则放出H2体积应相等;若一为强酸一为弱酸,则pH相等时弱酸 浓度大,因而放出H2多;弱酸稀释后电离程度增大,pH改变小,
13.A b路线反应吸热,从平衡的角度考虑升高温度有利于提高乙醇的转化率,A错;由盖斯定律可得D正确。
26.(1)2.5×l0 (3分)
(3分)
(2)N2(g)+3H2O(1) 2NH3(g)+
2NH3(g)+ O2(g)
O2(g)

 (3分)
(3分)
(3)升高温度;加压;不断移出生成物脱离反应体系(合理均可,3分)
(4)①0.9375 (3分)②0.7 (2分)3.2(2分)
解析:(1)
 (3分)
(3分)
(4)① N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
起始 /mol 0.80 1.60 0
/mol 0.80 1.60 0
转化 /mol
/mol  3
3 2
2
平衡n/mol 0.80― 1.60一3
1.60一3 2
2

解得:
则
② 由温度相同知 设平衡时N2物质的量为
设平衡时N2物质的量为


由等效转化可求起始时N2、H2的物质的量。
27.(1)铁红(1分)
(2) (2分)
(2分)
(3) +3SO
+3SO +3Ba
+3Ba +6OH
+6OH ====2Al(OH)3↓+3BaSO4↓(3分)
====2Al(OH)3↓+3BaSO4↓(3分)
AI(OH)3+ OH =====AlO
=====AlO +2H2O(3分) 第3周期ⅢA族(2分)
+2H2O(3分) 第3周期ⅢA族(2分)
(4)8Al+3Fe3O4 9Fe+
9Fe+
28.(1)2CaO2==== 2caO+O2(3分)
(2)过滤(2分)蒸发、结晶(2分)
(3)① 移动漏斗保持液面与量气筒液面相平(2分)80%(3分)
② 不合理(1分) CaO会与H2O反应生成Ca(OH)2,由固体质量减少不能确定H2O的量(3分)
29.(1)CH CH(2分)
CH(2分)
(2) (2分)
(2分)
(3)acd(2分)
(4) (2分)
(2分)
(5)
解析 相对分子质量最小的不饱和烃为乙炔,从组成上分析,三个乙炔加成得苯,C、D均能发生银镜反应,所以C、D均含有醛基,根据醛基的化学性质,E为羧酸,F为醇,G为酯。苯与乙炔最简式相同,等质量的两种混合物燃烧消耗氧气的量相等,苯与苯甲酸氢原子个数相等,从组成上相差一个“CO

物 理 部 分
题号
14
15
16
17
18
19
20
21
答案
A
C
B
A
BD
BC
BCD
AD
14.A 由牛顿运动定律: ,得
,得 ,再由牛顿第三定律可判定A项正确.
,再由牛顿第三定律可判定A项正确.
15.C 在第1 s内滑块的平均速度为 .在第2 s内滑块的平均速度为
.在第2 s内滑块的平均速度为
同理第3 s内的平均速度 .故有
.故有


所以 ,C项正确.
,C项正确.
16.B 金属板折成“ ”形的金属槽放在磁感应强度为B的匀强磁场中,并以速率
”形的金属槽放在磁感应强度为B的匀强磁场中,并以速率 向 右匀速运动时,左板将切割磁感线,上、下两板间产生电势差,由右手定则可知判断出上板为正,下板为负,
向 右匀速运动时,左板将切割磁感线,上、下两板间产生电势差,由右手定则可知判断出上板为正,下板为负, ,微粒做匀速圆周运动,重力等于电场力,方向相反,故有
,微粒做匀速圆周运动,重力等于电场力,方向相反,故有 ,向心力由洛伦兹力提供,所以
,向心力由洛伦兹力提供,所以 ,得
,得 ,周期
,周期 ,故B项正确.
,故B项正确.
17.A 等势面与场强方向垂直,空间中任意一点的场强方向是A1B1和A2B2分别产生的场强的矢量和,所以可以求出任意点的场强方向,根据等势面与场强方向垂直可确定该点的等势面方向.
18.BD A、B间的作用力大小相等、方向相反,故A项错误;A、B有可能静止在斜面,还有可能沿斜面向下运动,故B项正确;由力的合成知识可知A对斜面的压力大于H对斜面的压力,故C项错误;不管A、B做何种性质的运动,它们的运动情况相同,它们沿水平方向的分运动的加速度相同,由 ,可知它们受到的合外力沿水平方向的分力相等,故D项正确.
,可知它们受到的合外力沿水平方向的分力相等,故D项正确.
19.BC 由 可知,
可知, 、
、 不变时,
不变时, 增大,
增大, 增大,故A错,B正确;汽车做匀加速运动时,汽车受到的合外力
增大,故A错,B正确;汽车做匀加速运动时,汽车受到的合外力 不变.由
不变.由 知C项正确;由
知C项正确;由 ,汽车 匀加速运动时,经相同的位移所需的时间不一样,故汽车的速度变化也不相等,D项错误.
,汽车 匀加速运动时,经相同的位移所需的时间不一样,故汽车的速度变化也不相等,D项错误.
20.BCD 若虚线方框内添加“与门”,则有光照射光敏电阻时,路灯发光,故A项错误;在方框内添加“非门”时,能起到光控的效果,故B项正确;当R1阻值更大些时,RG的分压
作用越小,加在方框内元件两端的电压越大,故天更暗时路灯才会亮,C项正确;显然,D项也正确.
21.AD 网球在水平方向上做匀速运动,竖直方向上做自由落体运动,设球自飞出至网正上方所用时间为 ,从网正上方至落地所需时间为
,从网正上方至落地所需时间为 ,则有
,则有 /
/ =2/l,所以有
=2/l,所以有 ,解得
,解得 项正确;如图所示的临界状态中,
项正确;如图所示的临界状态中, ,可见当
,可见当 时,球将下网,故B项错误;若降低高度,球正好落在对方边界线上,则有
时,球将下网,故B项错误;若降低高度,球正好落在对方边界线上,则有 故有
故有 得
得 ,故
,故 时,若增大
时,若增大 使球过网,则球必将出界,故C项错误;显然D项正确.
使球过网,则球必将出界,故C项错误;显然D项正确.
 22.(1)(a)1.50 (b)1.60 (c)2.40(每空2分,共6分)
22.(1)(a)1.50 (b)1.60 (c)2.40(每空2分,共6分)
(2)① 的图线 (1分)
的图线 (1分)
② (2分) 大于(1分)
(2分) 大于(1分)
③ 电路图:(见右图) (3分)
实验步骤(2分,任写对3项都得满分):
(a)按电路图连接好电路;
(b)闭合开关S,移动滑片P使滑动变阻器短路,测得两电表读数为U1、I1;
(c)移动滑片P使滑动变阻器不短路,测得两电表读数为U2、I2;
(d)整理器材,数据处理.
计算公式:
(a) (1分) (b)
(1分) (b) (1分)(c)
(1分)(c) (1分)
(1分)
23.解:(1)设棒速为 ,有
,有 (2分) ①
(2分) ①
 (2分) ②
(2分) ②
棒受力平衡有: (2分) ③
(2分) ③
联立得: 方向向上 (3分) ④
方向向上 (3分) ④
(2) (2分) ⑤
(2分) ⑤
联①④⑤得: (3分)
(3分)
24.解:(1)撤力前后木板先加速后减速,设加速过程的位移为 ,加速度为
,加速度为 ,加速运动的时间为
,加速运动的时间为 ;减速过程的位移为
;减速过程的位移为 ,加速度为
,加速度为 ,减速运动的时间为
,减速运动的时间为 .由牛顿第二定 律得撤力前:
.由牛顿第二定 律得撤力前:
 (2分)
(2分)
解得 (1分)
(1分)
撤力后: (2分)
(2分)
解得 (1分)
(1分)
 (2分)
(2分)
为使小滑板不从木板上掉下,应满足 (2分)
(2分)
又 (2分)
(2分)
由以上各式可解得
即作用的最长时间为1 s. (2分)
(2)木板在拉力 作用下的最大位移
作用下的最大位移 (2分)
(2分)
所以F做功的最大值 (2分)
(2分)
25.解:(1)设两板问电压为 时,带电粒子刚好从极板边缘射出电场,
时,带电粒子刚好从极板边缘射出电场,
则有 (2分)
(2分)
代人数据,解得: (2分)
(2分)
 在电压低于100 V时,带电粒子才能从两板间射出,电压高于100 V时,带电粒子打在极板上,不能从两板间射出.粒子刚好从极板边缘射出电场时,速度最大,设最大速度为
在电压低于100 V时,带电粒子才能从两板间射出,电压高于100 V时,带电粒子打在极板上,不能从两板间射出.粒子刚好从极板边缘射出电场时,速度最大,设最大速度为
则有: (2分)
(2分)
解得: (2分)
(2分)
(2)设粒子进入磁场时速度方向与 夹角为
夹角为 ,则速度大小
,则速度大小 (2分)
(2分)
粒子在磁场中做圆周运动的轨道半径 (2分)
(2分)
粒子从磁场中飞出的位置与进入磁场的位置之间的距离 (2分)
(2分)
代入数据,解得 与
与 无关,即射出电场的任何一个带电粒子进入磁场的入射点与出射点间距离恒为定值 (2分)
无关,即射出电场的任何一个带电粒子进入磁场的入射点与出射点间距离恒为定值 (2分)
 (3)粒子飞出电场进入磁场,在磁场中按逆时针方向做匀速圆周运动.粒子飞出电场时的速度方向与
(3)粒子飞出电场进入磁场,在磁场中按逆时针方向做匀速圆周运动.粒子飞出电场时的速度方向与 的最大夹角为
的最大夹角为
 (2分)
(2分)
当粒子从下板边缘飞出电场再进入磁场时,在磁场中运动时间最长,
 (2分)
(2分)
当粒子从上板边缘飞出电场再进人磁场时,在磁场中运动时间最短
 (2分)
(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com