
题目列表(包括答案和解析)
(14分)工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下:
回答下列问题:
(1) 已知: N2(g) + O2(g)  2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol
4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH ?905kJ/mol
?905kJ/mol
2H2(g) + O2(g)  2H2O(g) ΔH
2H2O(g) ΔH ?483.6kJ/mol
?483.6kJ/mol
则N2(g) + 3H2(g) ≒ 2NH3(g) ΔH ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(14分)工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下:
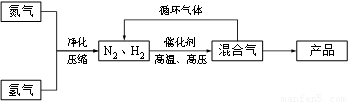
回答下列问题:
(1) 已知: N2(g)
+ O2(g)  2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol
4NH3(g)
+ 5O2(g)  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH −905kJ/mol
−905kJ/mol
2H2(g)
+ O2(g)  2H2O(g) ΔH
2H2O(g) ΔH −483.6kJ/mol
−483.6kJ/mol
则N2(g)
+ 3H2(g) ≒ 2NH3(g) ΔH  ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
工业上合成氨是在一定条件下进行如下反应:![]()
![]()
![]() ,其部分工艺流程如下:
,其部分工艺流程如下:

4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g) ![]() 2NH3(g)的△H=_________。
2NH3(g)的△H=_________。
(2)如果工业上,在一定温度下,将1.5molN2气体和6molH2气体通入到体积为l升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_____。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列哪种方法? ____________(填编号)。①过滤 ②蒸馏 ③渗析 ④萃取
理由是 。
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为:_____________。
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水 mL,(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pn 14-a(填“大于”“小于”或“等于”)

 2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH ?905kJ/mol
?905kJ/mol 2H2O(g) ΔH
2H2O(g) ΔH ?483.6kJ/mol
?483.6kJ/mol ________________。
________________。 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。某厂的酸性工业废水中含有一定量的Na+、Al3+、Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。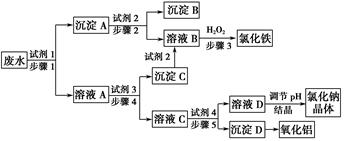
请填写下列空白:
(1)图中试剂1是________,试剂2是________。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为__________________________________。
(4)步骤3反应的离子方程式为__________________________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为____________________________。
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
答案
B
C
A
C
D
B
C
A
A
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个就得0分)
题号
10
11
12
13
14
15
16
17
18
答案
BC
A
D
BD
AC
AC
C
C
BD
三、(本题包括3小题,共34分)
19.(一)(6分)
(1)热的Na2CO3会发生水解反应使溶液碱性,在碱性条件下使油脂充分水解而除去(2分)
(2) 浓缩至液体表面出现洁净薄膜(1分)
(3) 在相同温度下,(NH4)2SO4•FeSO4•6H2O的溶解度比(NH4)2SO4、FeSO4小(1分) ;
7(m1―m2)g (1分)
(二).(共5分)
(1)酸式(1分) 5Fe2+ + MnO4- + 8H+= 5Fe3++ Mn2+ + 4H2O(2分)
(2)当最后一滴KMnO4酸性溶液滴下时,溶液变成紫色,30s内不褪色,说明达到滴定终点(1分)
(3)1/V(1分)
20.(10分)
[交流与讨论](1)2AI+2NaOH+2H20=2NaAl02+3H2 ↑ (2分)
(2)97mL (2分)
(3)滤纸破损;过滤时漏斗里的液面高于滤纸边缘;仪器不干净等(1分)
(4)偏高 (1分)
[实验拓展](4分) 
21、(13分)
(1)①产生二氧化硫没有干燥,水蒸气会与Na2O2反应;②在B、C之间加一个装有NaOH溶液的洗气瓶 除去SO2气体(每空1分,共3分)
(2) 2Na2O2+2CO2=2Na2CO3+O2↑(2分)
①提出合理假设
假设1:白色固体为Na2SO3 假设2:白色固体为Na2SO3与Na2SO4 的混合物
假设3:白色固体为Na2SO4(每空1分,共3分)
② (每空1分,共5分)
实验操作
预期现象与结论
步骤1:取少量白色固体于试管,加入足量的稀盐酸
若闻到刺激性气味,说明白色固体含有Na2SO3.
步骤2:在步骤1的溶液加入足量的氯化钡溶液
若有白色沉淀生成,则说明白色固体含Na2SO4.
若步骤1现象明显,而步骤2没明显现象,则说明白色固体为Na2SO3;若步骤1现象不明显,步骤2现象明显,则说明白色固体为Na2SO4;若上述两个实验现象均有,则说明白色固体既含有Na2SO3,又含有Na2SO4。
四、(本题包括3小题,共34分)
22.(12分)
(1)硅(2分)(2)原子 ,C3N4 ,高温、高压 (各2分,共6分)
(3)4Al + 3O2 = 2Al2O3 IIA(各2分,共4分)
23(14分)
(1)CuO+2H+→Cu2++H2O(2分)
(2)烧杯、量筒(4分,各2分)
(3)SO2(2分)
(4)取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有(2分)
(5)铜粉的质量(2分) 最终所得CuO的质量(2分)。
24 (8分)
(1)NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ?mol-1(2分)
(2)①>(2分) ②C(2分)
(3)①N2H62++H2O [N2H5?H2O]++H+(2分)
[N2H5?H2O]++H+(2分)
五、(本题包括1小题,9分)
25(9分)
(1)C6H6(1分)
(2)碳碳双键 酯基 (每个1分,共2分)
(3)分别取少量粗品和纯品于试管,分别加入NaHCO3溶液,若试管中有气泡产生,则原试剂为粗品。(其它合理答案也给分)(2分)
 |
(4) (2分)
(5) ;
; (每个1分,共2分)
(每个1分,共2分)
六、选做题(本题包括2小题,每小题10分,考生只能选做一题)
26.(10分)
⑴加成反应 消去反应 取代反应 (3分)
⑵ +2NaOH→
+2NaOH→ +2NaBr (2分)
+2NaBr (2分)
⑶ ③; 保护A分子中C=C不被氧化
 (5分)
(5分)
27.(10分)
(1)1s22s22p63s23p6 (1分)
(2)ZCl<Ycl<XCl (1分)
(3) Cu 4 (每空2分,共4分)
(4) CH3―CH2―Cl中与Cl原子成键的C以sp3杂化,而CH2=CH2―Cl中与Cl原子成键的C以sp2杂化,电子云密度不同;CH3―CH2―Cl中的C―Cl的键长比CH2=CH2―Cl中C―Cl要长;CH2=CH2―Cl的∏键对Cl的作用力比CH3―CH2―Cl的a键强。
(答对两点给2分)
(5)HF沸点比HCl高;氢氟酸是弱酸,盐酸是强酸;实验测得HF分子质量偏大。
(答对两点给2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com