
题目列表(包括答案和解析)
 Ⅰ、有机物的结构可用“键线式”简化表示,如:CH3一CH=CH-CH3可表示为
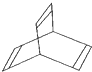
Ⅰ、有机物的结构可用“键线式”简化表示,如:CH3一CH=CH-CH3可表示为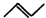 ,有一种有机物X的键线式如图所示.
,有一种有机物X的键线式如图所示.



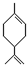
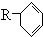 (R代表烃基),写出A可能的结构简式有
(R代表烃基),写出A可能的结构简式有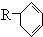 表示) 和Cl2发生1,4加成反应的化学方程式
表示) 和Cl2发生1,4加成反应的化学方程式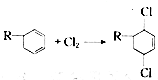

用NA、表示阿伏加德罗常数,下列说法正确的是
A.32g氧气与足量钠完全燃烧转移的电子数为2NA
B.1mol 甲基(—CH3)所含电子数10 NA
C.在标准状况下2.24L一氧化氮与氮气混合气所含分子数为0.1NA
D.2Lmol/L的盐酸溶液中,所含氯化氧分子个数是2NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com