
题目列表(包括答案和解析)
已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30。其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体。回答下列问题:
(1)在地壳中A、B元素的含量的关系为 大于 (用元素符号回答)。
(2)AO2和BO2分别为A和B的最高价氧化物,两种氧化物中含有π键的物质的电子式
为 。从原子半径大小的角度分析,A或B与氧原子形成π键难易程度的差异 。
(3)C元素在元素周期表中的位置为 ,其最高化合价为 。C单质晶体的堆积方式为 ,每个晶胞中实际占有C原子的个数为 。
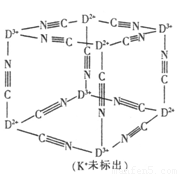
(4)D与E同族且不相邻,D存在D2+和D3+两种常见离子,它们与K+及CN-能形成一种可溶性蓝色化合物,用作染料。它的结构单元如图所示,则在该晶体中n(CN-):n(K+):n(D3+):n(D2+)= ,该蓝色化合物可以由D3+与K4〔D(CN)6〕制得,也可由D2+与K3〔D(CN)6〕制得。请写出K4〔D(CN)6〕与Cl2反应生成K3〔D(CN)6〕的化学方程式 。
一定温度下,向一容积为2L的恒容密闭容器中充入2molA与3molB,在一定条件下反应:A(g) +3B(g)![]() xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,已知2min内用C物质的浓度变化量表示的平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知反应速率v(B) : v(C)=3 : 2 ,试计算:
xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,已知2min内用C物质的浓度变化量表示的平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知反应速率v(B) : v(C)=3 : 2 ,试计算:
(1)x、y的值分别分别是 和
(2)平衡时反应物A的转化率
(3)平衡常数K= (可以用分数表示)
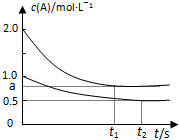 向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:| 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1 molA 1 molB |
0.5 molA 0.5 molB |
| A、x=1 |
| B、Q1>2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充入0.2mol A、0.2mol B、0.2mol C,则此时v(正)>v(逆) |
 用中和滴定法测定某烧碱的浓度.请回答主要操作过程中的有关问题:
用中和滴定法测定某烧碱的浓度.请回答主要操作过程中的有关问题:| 滴定序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
| 滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V |
| 2 | 20.00 | 6.10 | 26.00 | |
80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4
 2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
N(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 mol·L-1·s-1
(2)计算在80℃时该反应的平衡常数K= ;
(3)要增大该反应的K值,可采取的措施有(填序号) ;
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
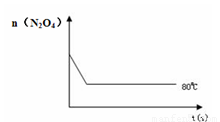
(4)如右图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com