
题目列表(包括答案和解析)
| 312 |
| a3NA |
| 312 |
| a3NA |

[化学——选修物质结构与性质]
有A、B、C、D、W五种元素.W的原子序数为29,其余的均为短周期元素;其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两对成对的电子;C元素氢化物与其最高价氧化物对应水化物之间反应生成一种盐;D原子核内的质子数与中子数相等,能与B形成DB2、DB3常见化合物.根据以上条件,回答下列问题:
(1)推断元素名称:A________.
(2)C元素的氢化物的空间构型为________,中心原子的轨道杂化类型为________,其分子为________分子(填“极性”或“非极性”).
(3)比较A、B、C三种元素的电负性由大到小的顺序是________(用元素符号表示),A、B、C三种元素的氢化物的晶体类型是________.
(4)D元素原子基态时的电子排布式为________,其在元素周期表中的位置是________.
(5)W元素+2价离子的水溶液呈现天蓝色,是该离子与水分子通过________键形成的________(填化学式)而显示出的颜色;W元素的某种氧化物的晶体结构如图所示,其中实心球表示W元素原子,则一个晶胞中所包含的氧原子数目为________.
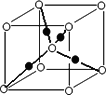
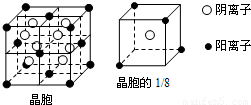
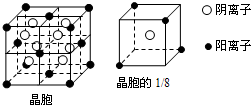 【选修-物质结构与性质】A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水.A和E可形成离子化合物,其晶胞结构如下图所示:
【选修-物质结构与性质】A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水.A和E可形成离子化合物,其晶胞结构如下图所示:
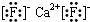
[化学一一选修物质结构与性质]
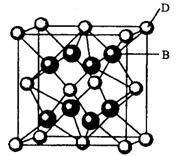
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示。请回答下列问题。
(1)E元素原子基态时的电子排布式为 ;
(2)A2F分子中F原子的杂化类型是 ,F的氧化物FO3分子空间构型为 ;
(3)CA3极易溶于水,其原因主要是 ![]() ,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
。

(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为ag·cm-3。,则晶胞的体积是 (写出表达式即可)。
第I卷共21小题,每小题6分,共126分。
一、选择题:本题共13小题,每小题6分,共78分
1―5CDACB 6―10ACDBD 11―13DCA
二、选择题:本题共8小题,每小题6分,共48分。全部选对的给6分,部分选对的给3分,有选错的给0分。
14.A 15.AD 16.BC 17.C 18.AD 19.B 20.C 21.B
第Ⅱ卷共17题,共174分
(一)必考题(8分,共129分)
22.(15分)
(1)0.552~0.554(结果在此范围内得3分)
(2)①刻度尺(2分)
②刻度尺 小球在木板上的落点的斜槽末端的水平距离s(2分)
刻度尺 斜槽末端到木板的竖直高度H(2分)
③.files/image110.gif) (2分)
(2分) .files/image112.gif) (2分)
(2分)
④AD(全部选对得2分,选对但不全得1分)
或者
①刻度尺 秒表(1分)
②刻度尺 小球在木板上的落点到斜槽末端的水平距离s(2分)
秒表 小球从斜槽末端下落到木板上的时间t(1分)
③.files/image110.gif) (2分)
(2分) .files/image115.gif) (2分)
(2分)
④AD(全部选对得2分,选对但不全得1分)
23.(15分)解:
(1)B球到达最低点时,系统减少的机械能
.files/image117.gif) (2分)
(2分)
因为.files/image119.gif) (2分)
(2分)
所以.files/image121.gif) (1分)
(1分)
(2)A球到达最低点时,由系统机械能守恒得:
.files/image123.gif) (3分)
(3分)
AB具有相同的角速度,转动半径.files/image125.gif)
所以.files/image127.gif) (2分)
(2分)
A、B下落的高度分别为
.files/image129.gif) ,(2分)
,(2分)
可得.files/image131.gif) (3分)
(3分)
24.(17分)解:
(1)设ab边刚进入磁场I区域时的速度为.files/image133.gif) ,由动能定理得:
,由动能定理得:
.files/image135.gif) (1分)
(1分)
.files/image137.gif)
.files/image139.gif) (1分)
(1分)
.files/image141.gif) (1分)
(1分)
ab间的电压.files/image143.gif) (2分)
(2分)
(2)线框ab边运动到NN′位置之前,只有ab边从PP′位置沿斜面下滑2L的过程产生感应电流,设线框ab边在II区域匀速运动的速度为.files/image145.gif) ,线圈中电流为I2,ab和cd两个边切割磁感线,总电动势
,线圈中电流为I2,ab和cd两个边切割磁感线,总电动势
.files/image147.gif) (2分)
(2分)
.files/image149.gif) (1分)
(1分)
ab和cd两个边受沿斜面向上的安培力,
.files/image151.gif) (2分)
(2分)
线框做匀速运动时,.files/image153.gif) (1分)
(1分)
.files/image155.gif)
根据能量转化与守恒定律
.files/image157.gif) (3分)
(3分)
.files/image159.gif) (3分)
(3分)
25.(14分)
(1)一定含NH4+、Al3+、Fe2+、SO42-、Cl-(各1分,错答正误抵消)
(2)一定不含有NO3-(1分);根据题意判断出溶液中一定含有Fe2+,而向溶液中加盐酸酸化后无明显现象,说明没有NO3-(2分)
(3)可能含有Na+(1分)焰色反应(2分)
(4)依据题意,进行定性、定性分析可知n(NH4+)=0.2mol、n(Al3+)=0.1mol、n(Fe2+)=0.2mol、
n(SO42-)=0.3mol,溶液中没有NO3-,根据电荷守恒必须存在Cl-(3分)
(其他合理答案参照给分)
26.(14分)
(1)60%(2分) 0.6mol/L(2分) -41kJ/mol(2分)
(2)0.6mol/L(1分),始起的浓度是相同的,属于等效平衡。(平衡浓度只与参加反应的物质的总浓度有关,而与过程(是一步还是分步完成)无关)或答依据化学平衡常数计算。(其他合理答案参照给分)(1分)
(3)C D(2分)(多选或选错都不得分)
|