
题目列表(包括答案和解析)

| ||
. |
| 1 |
| 6 |
| 1 |
| 6 |
(15分)能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
I.已知:Fe2O3(s)+3C(石墨) =2Fe(s)+3CO(g) △H=akJ·mol-1
CO(g)+1/2O2(g)= CO2(g) △H=bkJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=ckJ·mol-1
则反应:4Fe(s)+3O2(g)= 2Fe2O3(s)的焓变△H= kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)= 2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。
负极: ,
正极: 。
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:

已知:电解过程中发生的反应为:
NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。
①写出电解时阴极的电极反应式 。
②在阳极上放电的物质(或离子)是 。
③除去ClO2中的NH3可选用的试剂是 (填序号)
A.生石灰 B.碱石灰 C.浓H2SO4 D.水
④在生产过程中,每生成1mol ClO2,需消耗 mol NCl3。
高铁电池的总反应为:
3Zn +
2K2FeO4 + 8H2O 3Zn(OH)2 +
2Fe(OH)3 + 4KOH
3Zn(OH)2 +
2Fe(OH)3 + 4KOH
下列叙述错误的是 ( )
A.放电时每转移6mol电子,负极有2mol K2FeO4被还原
B.充电时阴极反应为:Zn(OH)2 + 2e— = Zn + 2OH—
C.放电时正极反应为:FeO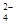 + 3e— + 4H2O = Fe(OH)3
+ 5OH—
+ 3e— + 4H2O = Fe(OH)3
+ 5OH—
D.充电时Zn电极与外电源的负极相连
(18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是 ,该反应将太阳能转化为 。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O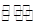 HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为 。
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |


理科综合参考答案
物理答案
一、选择题
14.B 15.D 16.C 17.D 18.A 19.AD 20.BC 21.B
二、非选择题

22.Ⅰ.①19.40 (2分)
②9.86 (3分)
Ⅱ.(1)①如图 (6分)
②375 Ω (3分)
(2)A (3分)
23.解:设汽车刚开始刹车时的速度为v0,汽车在刚通过第一段距离L时的速度为v
汽车通过第一段距离的平均速度v1=① (3分)
汽车通过第二段距离的平均速度v2=② (3分)
汽车运动的加速度a=③ (3分)
又v=v1-at/2④ (3分)
联立①②③④解得:v= (2分)
其他解法酌情给分。
24.解:
(1)设滑块刚要与炸药包接触时的速度为v1
对滑块和木板系统在爆炸前:mv0=2mv1① (2分)
解得:v1= 水平向右 (2分)
对滑块与木板系统在爆炸前应用功能关系:
μmgL=mv-×(2m)v② (2分)
设爆炸后滑块和木板的速度分别为v1′、v2′,最终滑块相对静止于木板的左端时速度为v2,系统在爆炸过程、爆炸前后动量守恒:
mv0=mv+mv③ (1分)
mv0=2mv2④ (1分)
对系统在爆炸后应用功能关系:μmgL=mv+mv-×(2m)v⑤ (2分)
由②③④⑤解得:v=0;v=v0,水平向右. (2分)
(2)爆炸前,对木板应用动能定理:μmgs1=mv-0⑥ (2分)
爆炸后,对木板应用动能定理:-μmgs2=mv-mv⑦ (2分)
所以木板对地的总位移:s=s1+s2⑧ (1分)
由以上各式解得:s=2 L,水平向右⑨ (2分)
其他解法酌情给分。
25.解:
(1)带电粒子在第二象限内受恒力的作用,必沿AO方向做匀加速直线运动过O点,因为AO与x轴夹角为45°.
有:E1q=mg (2分)
可得E1=5 V/m或7.07 V/m (2分)
(2)在第二象限内重力与电场力的合力:
F合==×10-3 N (2分)
加速度a==10 m/s2 (1分)
从A点到O点的过程中应用动能定理可得:
+F合?sAO=mv2-0 (2分)
解得v=2 m/s 且速度方向与x轴正方向成45° (1分)
进入第四象限后由于E1q=E2q=mg
所以带电粒子在洛伦兹力的作用下做匀速圆周运动
有:qvB=m① (2分)
如图所示,当再次进入第二象限时,据对称性知v的方向必垂直AO连线即垂直F合方向,粒子将做类平抛运动,据平抛运动知识和三角形知识可得:
沿F合方向上:R=at2② (2分)
垂直F合方向上:R=vt③ (2分)
联立①②③可得 R= m B=2.5 T (1分)
(3)据三角形和圆周运动知识可得:
在第三四象限里的圆周运动时间t1
t1=T④ (1分)
T=⑤ (1分)
在第二象限里的平抛运动时间t2
t2=⑥ (1分)
由④⑤⑥联立可得t=t1+t2= s或1.61 s (2分)
其他解法酌情给分。
化学答案
一、选择题
6.B 7.D 8.C 9.D 10.B 11.D 12.A 13.C
二、非选择题
26.(1)A、D(全部选对给3分;只选一个且正确给1分;只要错选为0分)
(2)⑤;1;①(各1分)
(3)复分解反应能够向生成更难溶(溶解度更小)物质的方向进行(3分);白色固体变为黄色(2分);I-+AgCl===AgI+Cl-(3分)
27.(1)NCCN(2分);CN-+H2O??HCN+OH-(3分)
(2)氰胺电子式:H??\o(??C⋮⋮N(2分)
(3)NNNH2NNH2NH2(2分);
NNNH2NNH2NH2+3HCl+3H2?→NNNHOOHOH+3NH4Cl(3分)
(4)N2H2(l)+O2(l)===N2(g)+2H2O(l) ΔH=-621.23 kJ?mol-1(3分)
28.(1)加成反应;消去反应(各1分)
(2)HOCH2CH2CH2CHO(2分)
(3)HOCH2CH2CH2COOH浓硫酸△+H2O(3分)
(4)CH2CHCHCH2+CH2CHCOOHCOOH(3分)
(5)CHCH2(2分)
(6)d(2分)
29.(1)78.3(2分);100(1分)
(2)取滤液少许,加入NaOH,加热,生成的气体能使润湿的红色石蕊试纸变蓝(合理即给分)(2分)
(3)Al(OH)3、Al2O3、Fe2O3(3分)
(4)K2SO4、(NH4)2SO4(2分)
(5)BaCl2;过滤;洗涤;干燥(4分)
(6)(3分)
生物答案
一、选择题
1.D 2.A 3.C 4.C 5.C
二、非选择题
30.Ⅰ.(1)③ 增加
(2)NaHCO3
(3)胰岛素 大于 自身蛋白质的分解 氨基转换作用
(4)过多的血糖会转化成脂肪储存 (每空2分)
Ⅱ.①不足之处:没有进行饥饿处理
修改为:将天竺葵放置在黑暗处24小时
②不足之处:没有说明天竺葵的生长发育状况是否一致
修改为:选取生长发育状况一致的天竺葵
③不足之处:没有说明叶片选取是否一致
修改为:选取叶龄相同、大小相似的叶片
④不足之处:没有对所有材料编号
修改为:将四组实验装置以及培养皿等编号 (每空1分)
(注:答出三项即可,只要符合实验设计原则,答案合理即可给分)
31.(1)4 1AA∶2Aa∶1aa
(2)8%[100%-(1/2×100%+1/4×88%+1/4×80%)=8%或20%×1/4+12%×1/4=8%]
(3)从窄叶植株上采种(含Aa、aa),次年播种后,选择宽叶植株栽种
(4)Ⅰ.AaBb
Ⅱ.AaBb(♀) aabb(♂) →AaBb、Aabb、aaBb、aabb
Ⅲ.播种以上收获的种子并分别进行自交,从自交后代中选取宽叶甜玉米再连续自交,直至不发生性状分离,收获基因型为AAbb的种子。
Ⅳ.AAbb(♀)×aabb(♂)→Aabb [高产(杂交种)、抗虫、甜玉米] (每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com