
题目列表(包括答案和解析)
(9分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g) 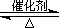 2SO3(g) ?H="-196.6" kJ·mol-1
2SO3(g) ?H="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H="-113.0" kJ·mol-1
2NO2(g) ?H="-113.0" kJ·mol-1
(ⅰ)则反应NO2(g)+SO2(g) SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.每消耗1 mol SO3的同时生成1 mol NO2 B. 体系压强保持不变
C. 混合气体颜色保持不变 D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)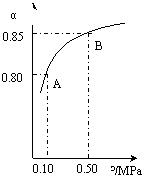
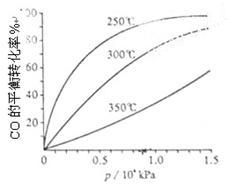
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
(9分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g)
 2SO3(g) ?H="-196.6"
kJ·mol-1
2SO3(g) ?H="-196.6"
kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H="-113.0"
kJ·mol-1
2NO2(g) ?H="-113.0"
kJ·mol-1
(ⅰ)则反应NO2(g)+SO2(g) SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.每消耗1 mol SO3的同时生成1 mol NO2 B. 体系压强保持不变
C. 混合气体颜色保持不变 D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)


(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
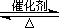 2SO3(g) ?H="-196.6" kJ·mol-1
2SO3(g) ?H="-196.6" kJ·mol-1 2NO2(g) ?H="-113.0" kJ·mol-1
2NO2(g) ?H="-113.0" kJ·mol-1  SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。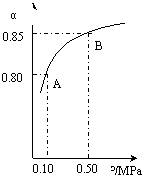
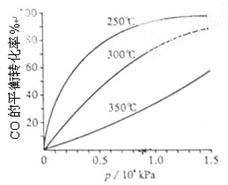
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。 设NA为阿伏加德罗常数的值,下列说法正确的组合是 ( )
a 12 g 金刚石中含有的碳碳键的数目为2NA
b 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1 mol·L-1的NH4NO3溶液中含有氮原子的数目为2 NA
e 标准状况下,2.24 L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol ? L-1 AlCl3溶液中阳离子总数大于0.1NA
| A.a c f h | B.a c e g | C.a c e f h | D.b d e h |
| A.a c f h | B.a c e g | C.a c e f h | D.b d e h |
一、选择题(126分)
1.D 2.B 3.A 4.D 5.C 6.A 7.A 8.B 9.B 10.C 11.B 12.D 13.C
二、选择题
14.A 15.C 16.B 17.C 18.D 19.AD 20.A 21.BC
 三、非选择题(174分)
三、非选择题(174分)
22.I.AD(6分)
Ⅱ.(1)电路图(6分):
(2)
 (6分)
(6分)
23.解(1)设小球运动到管口的时间为t,则由运动学公式,对玻璃管有:
S1=at2………①…………(2分)
对小球,做自由落体运动,有:S2=gt2………②…………(2分)
由几何关系知:S1-S2=L………③…………(2分)
解①②③得t=0.5s…………(1分)
则小球到达管口时的速度v=gt=
(2)设小球从开始运动到再次回到玻璃管底部下落的高度为h,
由几何关系知:h=L……⑤…………(2分)
设此过程的时间为t',对小球:h=gt’2……⑥…………(2分)
解得①④⑤⑥得:t'=0.63s
24.解(1)P、Q被推开瞬间水平速度大小分别为vp、vQ
由动量守恒定律得:mpvp=mQvQ……①…………(3分)
由能量守恒得E=mpv+mQv=E……②…………(3分)
解①②得vp=
(2)P恰好到达A点时,只有重力提供向心力,设P在A点的速度为vA,
则:mpg=mp……③…………(3分)
对P从D被推开后到A,由动能定理得:
mpv+mpv=-μmpgS1-mpg∙2R…………④…………(4分)
由③④得:S1=
所以:当0<S1≤
25.解析:(1)磁场向 方向运动,等效金属框向
方向运动,等效金属框向 方向运动。
方向运动。
t=0时刻,金属框产生的电动势 (2分)
(2分)
 (2分)
(2分)
电流的方向根据右手定则可知为 (2分)
(2分)
(2)设经过时间t,金属框MN所在处磁场强度为B,
又 ,得到电流瞬时值的表达式是:
,得到电流瞬时值的表达式是: ,是正弦式电流。(5分)
,是正弦式电流。(5分)
(3)  (5分)
(5分)
(4)金属框受安培力的方向始终向左。设经过时间t,金属框受到安培力为
 由此可知:金属框受到安培力F随时间变化的图象如下图: (6分)
由此可知:金属框受到安培力F随时间变化的图象如下图: (6分)
26.(14分)
(1)①H2SO4 (2分)②S(s)+O2(g) = SO2(g); 297
297 (2分)
(2分)
③A (2分)
(2)①C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O(2分)
②SO2+2CO = S+2CO2(2分)
③1.79t (4分)
27.(15分)(1)SO2 (2分) 4NH3+5O2  4NO+6H2O (2分)
4NO+6H2O (2分)
(2)第3周期第IIIA族(2分) 先产生白色沉淀,然后沉淀完全溶解(2分)
(3) +
+ =
=  + H2O(2分)n(NaHCO3):n(Na2CO3)=10┱1(3分)
+ H2O(2分)n(NaHCO3):n(Na2CO3)=10┱1(3分)
(4)④(2分)
28.(18分)(1)f、e、h、i、j、k、c(或d)、d(或c)、a(3分)
(2)吸收O2中的水蒸气(2分) 氧化没有燃烧完全的CO(2分)
2H2O2
 2H2O+O2↑
2H2O+O2↑
(3)1┱2┱2(2分)
(4)6CO(NH2) C3H6N6
+6NH3↑+3CO2↑(2分)
C3H6N6
+6NH3↑+3CO2↑(2分)
(5)尾部缺少一个干燥装置(2分)。空气中的水蒸气和CO2进入A装置,影响CO2的测定值(2分)。
29.(13分)(1)醛基(1分)
(2)①消去反应(1分)② (2分)
(2分)
③ (2分)、
(2分)、 (2分)
(2分)
④
 (2分)
(2分)
 +CH3COOH
+CH3COOH

 +H2O(3分)
+H2O(3分)
30.I.(14分)(1)等于(2分)(2)①适当升高温度(2分) 在一定的温度范围内,随着温度的升高,酶的活性增强,光合作用增强(2分) ②适当增大CO2的浓度(2分) 在一定的CO2浓度范围内,随着CO2浓度的增大,暗反应增强,光合作用增强(2分)(注:答案 ①与②的前后顺序可调换) (3)少(2分) 多(2分)
Ⅱ.(12分,每空2分)
(1)①实验动物数量太少(答案合理即可)
②A、B应放在相同的容器中培养
(2)①环境条件所允许的最大值(或K值或环境最大容纳量)
②S
③繁殖速度比B快(答案合理即可) 少
31.(16分)(1)基因突变 AA、Aa、aa
(2)①传粉前 花药
②单倍体幼苗 染色体加倍 AA或aa
③籽粒成熟(结种子、结果实)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com