
题目列表(包括答案和解析)
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
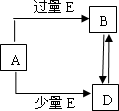
(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素.
①B属于________分子(填“极性”或“非极性”),电子式为________;
②4 g A单质完全燃烧放出131.2 kJ的热量,写出表示A单质燃烧热的热化学方程式________;
(2)若A为第三周期中的元素所形成的氯化物.
①写出A溶液→B的离子方程式________;
②写出A和B的溶液反应的离子方程式________.

(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
①B属于_________分子(填“极性”或“非极性”),B分子中各原子最外层_________(填“是”或“否”)都满足8电子结构;
②向50 mL 4 mol·L-1的NaOH溶液中通入
③
(2)若A为第三周期中的元素所形成的氯化物。
①写出A溶液B的离子方程式_________________________;
②写出A和B的溶液反应的离子方程式________________________。
(3)若A为常见的金属,在E的冷、浓溶液中,A有钝化现象。已知:X为含有非极性键的离子化合物,且1 mol X含有38 mol电子,向D溶液中加入与D等物质的量的X固体,恰好完全反应,写出该反应的离子方程式________________________。
 (08黄冈中学二模)(15分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。
(08黄冈中学二模)(15分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。
(1) 若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
① B属于分子 非极性 (填“极性”或“非极性”),B分子中各原子最外层 是 (填“是”或“否”)都满足8电子结构;
② 向50 mL4 mol/L的NaOH溶液中通入1.12 L B(标准状况),
反应后溶液中溶质的物质的量之比为 Na2CO3 :NaOH =1:2 (填化学式和物质的量之比);
③ 4 g A单质完全燃烧放出131.2 kJ的热量,写出表示A单质燃烧热的热化学方程式
C(s)+O2(g)= CO2(g);△H=393.6kJ/mol
(2) 若A为第三周期中的元素所形成的氯化物。
① 写出A溶液→B的离子方程式 Al3++4OH―=AlO2―+2H2O ;
② 写出A和B的溶液反应的离子方程式 Al3++3AlO2―+6H2O=4Al(OH)3↓ 。
(3) 若A为常见的金属,在E的冷、浓溶液中,A有钝化现象。已知:X为含有非极键的离子化合物,且1 mol X含有38 mol电子,向D溶液中加入与D等物质的量的X固体,恰好完全反应,写出该反应的离子方程式 4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+ 。
请完成下列问题:
(1)由A、B、C、D四种元素组成的酸式盐,在加热条件下发生的反应为____________。
(2)单质A和单质C在一定的条件下可生成化合物E,该反应的化学方程式为________________________;E晶体的空间构型为____________。
(3)4 g B单质在足量的D单质中完全燃烧放热131.17 kJ,试写出该反应的热化学方程式:____________________________________。
(4)在一定的温度下,向一个体积为2 L的密闭容器中通入2 mol单质A和8 mol C单质,3 min时达到平衡,测得E的浓度为1 mol·L-1,该时间内C的化学反应速率为____________。
(5)化合物CD与D2单质发生的反应为:2CD(g)+D2(g) ![]() 2CD2(g),现在一定温度下,在一个固定体积的密闭容器中,充入2 mol CD(g)和1 mol D2(g),在一定条件下达成平衡,测得CD的转化率为80%(容器内温度不变),此时,容器内的压强与起始压强之比小于_____________(填比值)。
2CD2(g),现在一定温度下,在一个固定体积的密闭容器中,充入2 mol CD(g)和1 mol D2(g),在一定条件下达成平衡,测得CD的转化率为80%(容器内温度不变),此时,容器内的压强与起始压强之比小于_____________(填比值)。
第I卷
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
A
B
B
C
C
B
B
B
A
B
D
13.(8分)
(1)①非极性 二氧化碳电子式略。 (各1分)
② C(s) + O2(g) = CO2(g) △H = -393.6kJ/mol 2分
(2) ① Al3+ + 4OH- = AlO2- + 2H2O 2分
② Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓ 2分
14.(10分)
(1)1nm~100nm(1分)
(2)Fe FeS H2SO4(稀)(3分)
(3)①H H(1分)
H(1分)
②2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(4)取少量E于试管中,用胶头滴管入NaOH溶液,加热试管,可观察到试管口处
湿润的红色石蕊试纸变蓝。(或其他合理答案)(3分)
15.(8分)
(1)K= (2分) 放热 (1分)
(2)b (1分) 1.5×10-3mol?L-1?s-1 (2分)
(3)bc (1分) (4)c (1分)
16.(10分)
方案一 (1) 保证NaHCO3全部分解 (1分)
方案二
(2)①检查装置的气密性(1分) 硫酸 (1分)
防止空气中水蒸气、CO2进入C管被吸收(1分)
② C (1分)
③需设计一将A、B中的CO2全部吹入C中吸收的气体装置(1分)
方案三
(3)①玻璃棒(1分)
②取少量滤液,再滴加BaCl2少许,如无白色沉淀说明沉淀完全(1分)
③ 51%(2分)
17.(18分)
(1)加成反应 (还原反应)(1分);
(2) CH3COOH 1分
 Br2CH― ―OOCCH3 ;
2分
Br2CH― ―OOCCH3 ;
2分
|