
题目列表(包括答案和解析)
(12分) 通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;
(2)X与金属钠反应放出氢气,反应的化学方程式是
________________________________________________(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是_________________;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率。(要求写出计算过程)
Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
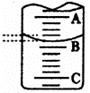
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.32 | 25.34 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗
C.第一次滴定用的锥形瓶用白醋润洗
D.该NaOH标准液保存时间过长,有部分变质,浓度降低
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
Ⅱ. 用中和滴定法测定NaOH和Na2CO3混合溶液中的NaOH的质量分数时,可先在混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞做为指示剂)。试回答:
(1)向混有BaCO3沉淀的NaOH溶液里滴加盐酸,为什么不会使BaCO3溶解而能测定NaOH溶液的质量分数?
(2)分析在滴定过程中不断振荡锥形瓶的原因?
(3)滴定终点时溶液颜色如何变化?
(4)能否改用甲基橙作指示剂?并说明理由。
(10分)不同浓度的硫酸与锌反应时,产物 不同。为了验证这一事实,某同学拟用下图装置进行实验(假设实验条件为压强为101 kPa,温度为0℃)。
不同。为了验证这一事实,某同学拟用下图装置进行实验(假设实验条件为压强为101 kPa,温度为0℃)。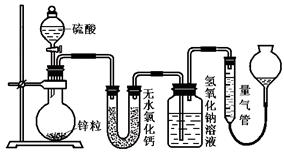
(1)若在烧瓶中放入1.3g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的量程应不小于 ml。
(2)若1.3g锌粒完全溶解,氢氧化钠洗气瓶增重l.28 g,则圆底烧瓶中发生反应的化学方程式为: 。
g,则圆底烧瓶中发生反应的化学方程式为: 。
(3)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重m g,则整个实验过程产生的气体中,n(H2)+n(SO2)= mol。(用含字母的代数式表示,需化简)。
(4)反应结束后,为了准确地测量气体体积,量气管在读数时除了视线与液面的最低处相平外,还要注意:
① ② 。
(10分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
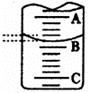
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.32 |
25.34 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗
C.第一次滴定用的锥形瓶用白醋润洗
D.该NaOH标准液保存时间过长,有部分变质,浓度降低
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
Ⅱ. 用中和滴定法测定NaOH和Na2CO3混合溶液中的NaOH的质量分数时,可先在混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞做为指示剂)。试回答:
(1)向混有BaCO3沉淀的NaOH溶液里滴加盐酸,为什么不会使BaCO3溶解而能测定NaOH溶液的质量分数?
(2)分析在滴定过程中不断振荡锥形瓶的原因?
(3)滴定终点时溶液颜色如何变化?
(4)能否改用甲基橙作指示剂?并说明理由。
(一)选择题
1.D 2.C 3.C 4.D 5.C 6.D 7.B、C 8.B 9.C 10.A 11.B 12.C、D 13.C、D 14 .B、C 15.B 16.D 17.D 18.D 19.B 20.C 21.A 22.A、B 23.B 24.D 25.D
(二)非选择题
1.答案为
2.(1)(A)4 (B)7 (C)5 (2)(D)4 (E)4 (F)2
3.(1)N2H4,
(2)H2N-NH2+H2OH2N-NH2?H2O
H2N-NH2?H2O+H2OH2O?H2N-NH2?H2O
4.(1)NxHy+O2N2+H2O (2)N2H4
5.(1)略 (2)14.7 (3)NOx(或NO、NO2)、CO.
6.(1)23.3% (2)1.26×1018kJ (3)A=[×6×44g/mol]÷1000或A= Q为每生成1 mol葡萄糖所需要吸收的能量(或:每消耗6 mol CO2所需吸收的能量)
7.(1)b、c、b、c、b (2)NaOH―CH3CH2OH溶液、加热
(3)
8.(1)甲酸甲酯,HCHO,
(2)CH3COONa+NaOHNa2CO3+CH3↑
(3)(或 ,
9.(1)3∶2∶3 (2)
10.(1)CH2O (2)30,60;CH2O,C2H4O2
14.(1)乙二醇,乙二酸
(2)①,②,④ (3)②,④
(4)
17.(1) 40%
(2)CH3CH2CH2CHO,(CH3)2CHCHO,
(3)CH2=CHCH(CH3)2
18.(1)2ClCH2COO?-2eClCH2CH2Cl+2CO2
2H2O+2eH2+2OH-
(2)
(3)
? ?n
19.(1)CaC2+2H2OCa(OH)2+C2H2↑
(2)CH≡CH+H2CH2=CH2
(3)CH2=CH2+HClCH3CH2Cl
20.(1)n(C)=0.160(mol) n(H)=0.120(mol) n(O)=0.08(mol)
(2)最简式为C4H3O2.
(3)
21.(1)4 (2)C4H6O4 (3)5,
(4)CH3OH, C2H5OH,H2O
22.A:CH―CH3―CH3,B:CH2―CH3―CH2OH,C:CH3CH2―O―CH3;A∶B∶C=1∶3∶6
|
OH
O
‖
23.(1)CH4,CH3―C―CH3
(2)CH2=C―COOH+CH3OHCH2=C―COOCH3+2H2O
| |
CH3 CH3
(3)加成,取代
COOCH3
|
(4)nCH2=C-COOCH3?CH2―C?n
| |
CH3 CH3
24.(1)CxHy+()O2mCO2+H2O+(x-m)CO (2)C4H8
(3)
分子式
n(CO)∶n(CO2)
C3H8
1∶2
C4H6
1∶3
O
‖
25.(1)(略) (2)缩聚nCH3 ―CH―COOHH?O―CH―C?n―OH+(n-1)H2O
| |
OH OH
O
‖
(3)H?O―CH―C?nOH+(n-1)H2OnCH3―CH―COOH
| |
OH OH
26.(1)6CO2+12H2OC6H12O6+6H2O+6O2
(2)C+O2=CO2
CnH2n+2+O2nCO2+(n+1)H2O
CH4+2O2=CO2+2H2O
CH4产生的CO2最小,对环境负面影响最小
27.(1)C9H10O2 (2)4
28.(1)O=C=C=C=O
O O
‖ ‖
(2)C3O2+2HClCl―C―CH2―C―Cl]
O O
‖ ‖
C3O2+2C2H5OHC2H5―C―CH2―C―OCH2
29.(1)C15H13O2F(或C15H13FO2)
30.(1)A,B;C,F;D,E (2)都有18O标记。因为反应中间体在消去一分子H2O 时,有两种可能,而乙氧基(OC2H5)是保留的。
(3)(或答中间体) ,因为这个碳原子连有4个原子团。
31.(1)C6H5―CH―NH―CO―C6H5+H2OC6H5―CH―NH2+C6H5COOH
| |
HO―CH―COOH HO―CH―COOH
(2)α (3)C31H38O11
32.(1)0.125;0.30;0.100;5:12:4
(2)可以;因为该最简式中H原子个数已经饱和,所以最简式即分子式C5H12O4
(3)C(CH2OH)4
33.(1)十肽 (2)4个谷氨酸 (3)3个苯丙氨酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com