
题目列表(包括答案和解析)
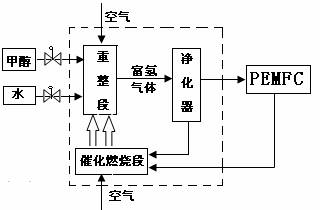 |
甲醇制氢气的主要途径有:
①CH3OH(g)+H2O (g)→3H2(g)+ CO2(g) △H= +49.0 kJ·mol-1
②CH3OH(g) + 1 /2O2(g) →2H2(g)+ CO2(g) △H= -192.9 kJ·mol-1
请回答下列问题:

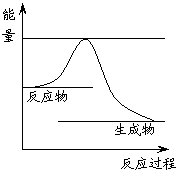 (1)反应①为 (“放”或“吸”)热反应,右图表示反应①在反应进行过程中能量(单位为kJ·mol-1)的变化示意图。试在答题纸对应的图像中用虚线表示在反应中使用催化剂后能量的变化情况。
(1)反应①为 (“放”或“吸”)热反应,右图表示反应①在反应进行过程中能量(单位为kJ·mol-1)的变化示意图。试在答题纸对应的图像中用虚线表示在反应中使用催化剂后能量的变化情况。
(2)催化重整段中把两种甲醇制取氢气的方法联合起来制 氢,其目的是 (写出一条即可) 。
(3)PEMFC工作时所产生的尾气(主要成份为H2)可循环应用于催化燃烧供热,则H2燃烧生成气态水时反应的热化学方程式为 。
(4)甲醇制氢质子交换膜燃料电池取代内燃机成为新一代汽车的动力,其优点有 。(填字母编号)
a.减少氮氧化物的排放 b.减少SO2的排放
c.降低对石油等化石燃料的依赖性 d.能量利用率高
(1)计算聚氯乙烯中氯的质量分数。
(2)制取聚乙烯的原料都来自于石油,而制取聚氯乙烯的原料除来自于石油外,还有HCl。现有1 t石油,试计算可得到多少吨聚乙烯和聚氯乙烯(理论上假设石油的全部成分为碳和氢,并且在生产聚乙烯、聚氯乙烯的过程中没有碳原子和氢原子的损失)。
(3)试根据上述信息及计算结果,谈谈该如何对待聚氯乙烯的使用。
![]()
(10分)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
实验步骤如下:
①在100 mL圆底烧瓶中加入12.20 g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按左上图所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图所示)。低温蒸出乙醚后,继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL.
回答下列问题:
⑴步骤①中使用分水器不断分离除去水的目的是 。
⑵步骤②中应控制馏分的温度在 。
| A.65~70℃ | B.78~80℃ | C.85~90℃ | D.215~220℃ |
(10分)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:

实验步骤如下:
①在100 mL圆底烧瓶中加入12.20 g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按左上图所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图所示)。低温蒸出乙醚后,继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL.
回答下列问题:
⑴步骤①中使用分水器不断分离除去水的目的是 。
⑵步骤②中应控制馏分的温度在 。
A.65~70℃ B. 78~80℃ C. 85~90℃ D. 215~220℃
⑶若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是 。
⑷蒸馏装置图中仪器A的名称是 ,在步骤④中加入氯化钙的作用是 。
⑸该实验产品的产率为 。
(一)选择题
1.D 2.C 3.C 4.D 5.C 6.D 7.B、C 8.B 9.C 10.A 11.B 12.C、D 13.C、D 14 .B、C 15.B 16.D 17.D 18.D 19.B 20.C 21.A 22.A、B 23.B 24.D 25.D
(二)非选择题
1.答案为
2.(1)(A)4 (B)7 (C)5 (2)(D)4 (E)4 (F)2
3.(1)N2H4,
(2)H2N-NH2+H2OH2N-NH2?H2O
H2N-NH2?H2O+H2OH2O?H2N-NH2?H2O
4.(1)NxHy+O2N2+H2O (2)N2H4
5.(1)略 (2)14.7 (3)NOx(或NO、NO2)、CO.
6.(1)23.3% (2)1.26×1018kJ (3)A=[×6×44g/mol]÷1000或A= Q为每生成1 mol葡萄糖所需要吸收的能量(或:每消耗6 mol CO2所需吸收的能量)
7.(1)b、c、b、c、b (2)NaOH―CH3CH2OH溶液、加热
(3)
8.(1)甲酸甲酯,HCHO,
(2)CH3COONa+NaOHNa2CO3+CH3↑
(3)(或 ,
9.(1)3∶2∶3 (2)
10.(1)CH2O (2)30,60;CH2O,C2H4O2
14.(1)乙二醇,乙二酸
(2)①,②,④ (3)②,④
(4)
17.(1) 40%
(2)CH3CH2CH2CHO,(CH3)2CHCHO,
(3)CH2=CHCH(CH3)2
18.(1)2ClCH2COO?-2eClCH2CH2Cl+2CO2
2H2O+2eH2+2OH-
(2)
(3)
? ?n
19.(1)CaC2+2H2OCa(OH)2+C2H2↑
(2)CH≡CH+H2CH2=CH2
(3)CH2=CH2+HClCH3CH2Cl
20.(1)n(C)=0.160(mol) n(H)=0.120(mol) n(O)=0.08(mol)
(2)最简式为C4H3O2.
(3)
21.(1)4 (2)C4H6O4 (3)5,
(4)CH3OH, C2H5OH,H2O
22.A:CH―CH3―CH3,B:CH2―CH3―CH2OH,C:CH3CH2―O―CH3;A∶B∶C=1∶3∶6
|
OH
O
‖
23.(1)CH4,CH3―C―CH3
(2)CH2=C―COOH+CH3OHCH2=C―COOCH3+2H2O
| |
CH3 CH3
(3)加成,取代
COOCH3
|
(4)nCH2=C-COOCH3?CH2―C?n
| |
CH3 CH3
24.(1)CxHy+()O2mCO2+H2O+(x-m)CO (2)C4H8
(3)
分子式
n(CO)∶n(CO2)
C3H8
1∶2
C4H6
1∶3
O
‖
25.(1)(略) (2)缩聚nCH3 ―CH―COOHH?O―CH―C?n―OH+(n-1)H2O
| |
OH OH
O
‖
(3)H?O―CH―C?nOH+(n-1)H2OnCH3―CH―COOH
| |
OH OH
26.(1)6CO2+12H2OC6H12O6+6H2O+6O2
(2)C+O2=CO2
CnH2n+2+O2nCO2+(n+1)H2O
CH4+2O2=CO2+2H2O
CH4产生的CO2最小,对环境负面影响最小
27.(1)C9H10O2 (2)4
28.(1)O=C=C=C=O
O O
‖ ‖
(2)C3O2+2HClCl―C―CH2―C―Cl]
O O
‖ ‖
C3O2+2C2H5OHC2H5―C―CH2―C―OCH2
29.(1)C15H13O2F(或C15H13FO2)
30.(1)A,B;C,F;D,E (2)都有18O标记。因为反应中间体在消去一分子H2O 时,有两种可能,而乙氧基(OC2H5)是保留的。
(3)(或答中间体) ,因为这个碳原子连有4个原子团。
31.(1)C6H5―CH―NH―CO―C6H5+H2OC6H5―CH―NH2+C6H5COOH
| |
HO―CH―COOH HO―CH―COOH
(2)α (3)C31H38O11
32.(1)0.125;0.30;0.100;5:12:4
(2)可以;因为该最简式中H原子个数已经饱和,所以最简式即分子式C5H12O4
(3)C(CH2OH)4
33.(1)十肽 (2)4个谷氨酸 (3)3个苯丙氨酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com