
题目列表(包括答案和解析)
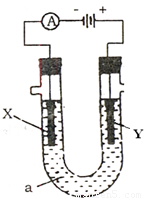
 B.电解原理在化学工业中广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
B.电解原理在化学工业中广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:| 实验序号 | 实验步骤 | 实验现象 | 结论 |
| ① | 用激光笔照射甲组制得的PAC溶液 | 光亮的通路 | |
| ② | 取乙组制得的样品少许加入铝试剂阿罗明拿 | 变成玫瑰红色 | |
| ③ | 取丙组样品少许,溶于适量的水制得的淡黄色透明液体中加入氟化铵 |
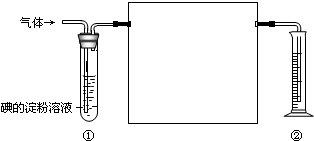 一混合气体中含有SO2、N2、O2,化学兴趣小组的同学欲测定其中SO2的体积分数,下图是他们在测定中使用的部分实验装置:
一混合气体中含有SO2、N2、O2,化学兴趣小组的同学欲测定其中SO2的体积分数,下图是他们在测定中使用的部分实验装置:某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水。与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+
甲同学设计的实验方案如下:
(1)方案中试剂M是 ;沉淀B是 。
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(3)若金属中含铝,则沉淀 (选填沉淀编号)的质量不为零;若金属中含锌,则沉淀 (选填沉淀编号)的质量不为零。
(4)乙同学对甲同学的方案做了如下改进:
与甲同学的方案相比,此方案的优点有 。
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是 。
(6)上题中当沉淀质量最大时,溶液呈 (从下列选项中选填,下同);当沉淀只有一种成分时,溶液可能呈 。
A.酸性 B.中性 C.碱性 D.可能酸性,也可能碱性
一、选择题
6.D 7.A 8.D 9.D 10.A 11.B 12.D 13.B
(化学部分).files/image148.jpg) 26.(16分)(1)
26.(16分)(1)(化学部分).files/image150.gif) (2)
(2)(化学部分).files/image152.gif) 极性、非极性、直线型
极性、非极性、直线型
(化学部分).files/image148.jpg) (3)
(3)(化学部分).files/image154.gif) (4)
(4)(化学部分).files/image156.gif) ,(5)
,(5)(化学部分).files/image158.gif)
(化学部分).files/image148.jpg) 27.(18分)
(1)①
27.(18分)
(1)①(化学部分).files/image160.gif)
(化学部分).files/image148.jpg) ②碱石灰(或
②碱石灰(或(化学部分).files/image162.gif) 或生石灰)
或生石灰)
(化学部分).files/image148.jpg) ③极易溶于水,水溶液呈碱性 ④B
③极易溶于水,水溶液呈碱性 ④B
(化学部分).files/image148.jpg) (2)让空气通过灼热的铜网 ①混合
(2)让空气通过灼热的铜网 ①混合(化学部分).files/image164.gif) 并使其干燥 ②观察导气管口气泡数量,调查气体流量,使
并使其干燥 ②观察导气管口气泡数量,调查气体流量,使(化学部分).files/image166.gif) 达最佳混合比1:3 将湿润的红色石蕊试纸靠近出气管口,试纸变量,说明气体为
达最佳混合比1:3 将湿润的红色石蕊试纸靠近出气管口,试纸变量,说明气体为(化学部分).files/image115.gif) (其他合理答案同样给分)
(其他合理答案同样给分)
(3)89.6L
28.(12分) (1)(化学部分).files/image169.gif)
(化学部分).files/image170.jpg)
(2)加成反应 强见的醇溶液、加热(化学部分).files/image171.jpg)
(化学部分).files/image173.jpg)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com