
题目列表(包括答案和解析)
(15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g)CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)=2H2O (l) △H=-571.6 kJ/mol
H2(g) +![]() O2(g)= H2O(g) △H=-241.8 kJ/mol
O2(g)= H2O(g) △H=-241.8 kJ/mol
①H2的燃烧热为 ▲ kJ/mol。
②CH3OH(g)+O2(g)CO(g)+2H2O(g)的反应热△H= ▲ 。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
A.CO百分含量保持不变
B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.CO的生成速率与CH3OH的生成速率相等
⑵工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g)CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
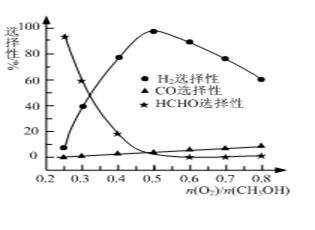
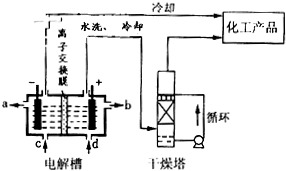
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ▲ ;在制备H2时最好控制n(O2)/n(CH3OH)= ▲ 。
⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为 ▲ 。
(15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) +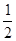 O2(g) = H2O(g) △H=-241.8 kJ/mol
O2(g) = H2O(g) △H=-241.8 kJ/mol
①H2的燃烧热为 ▲ kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热△H= ▲ 。
CO(g)+2H2O(g)的反应热△H= ▲ 。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
| A.CO百分含量保持不变 |
| B.容器中H2浓度与CO浓度相等 |
| C.容器中混合气体的密度保持不变 |
| D.CO的生成速率与CH3OH的生成速率相等 |
 CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。 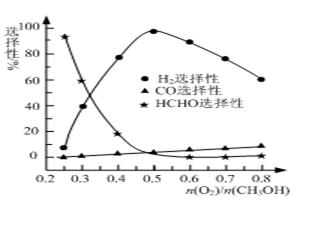
(15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) + O2(g)
= H2O(g) △H=-241.8 kJ/mol
O2(g)
= H2O(g) △H=-241.8 kJ/mol
①H2的燃烧热为 ▲ kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热△H= ▲ 。
CO(g)+2H2O(g)的反应热△H= ▲ 。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
A.CO百分含量保持不变
B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.CO的生成速率与CH3OH的生成速率相等
⑵工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ▲ ;在制备H2时最好控制n(O2)/n(CH3OH)= ▲ 。
⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为 ▲ 。

 CO(g)+2H2(g),此反应能自发进行的原因是___________________。
CO(g)+2H2(g),此反应能自发进行的原因是___________________。 

| ||
| ||
| △ |
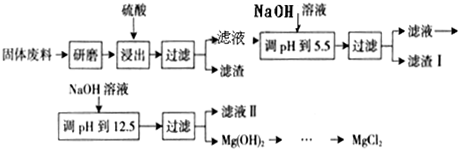
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
(一)选择题
1.B 2.D 3.B、D 4.A 5.B、D 6.C 7.B 8.C 9.D 10.C 11.2, 11.A 12.B 13.B 14.B 15.C 16.D 17.A 18.A
(二)非选择题
1.MgH2,酸足量时△1=,酸不足时 Δ1=A-1。AlH2,碱足量时Δ2=,碱不足时Δ2=B-3.
①酸碱均过量时,要使天平平衡需Δ1=Δ2,有的关系,取值范围0<A<12是对的。0<B<27是不对的,因为产生等量H2时 耗Al量比Mg少,故应由B==12.3 75,得0<B<12.375.②酸碱均不足时,并非A=B>12,应是A-1=B-3,即A=B-2,这是关 键,取值范围B>27,A>25而无上限(只需符合A=B-2)。③酸对Mg不足,碱对Al有余时,应为A-1=。取值范围怎样?酸对Mg不足,当然需A>12,这时B应由A-1=算式而定,将A>12代入知B>12.375,故B的取值范围为27>B>1 2.375.而Mg是否为27>A>12?不是的。当B<27时,A应由=A-1决 定,即=A-1得A=25,令B<27,则A<25,A的取值范围为12<A<25。④酸对Mg有余,碱对Al不足时,应有=B-3,而A<12,B>27,可见这种情况是不可能的。
2.(1)80% (2)40%
3.(1)因为在10℃、40℃、75℃时剩余固体量依次减少,所以说明10℃和40℃时溶液一定是 饱和的。
设加入的水为x.
(104-81)∶100=(201-132)∶x,解得x=300 g
(2)在75℃时,混合物中硝酸钠是否全部溶解了?设40℃到70℃时,在300g水中又溶解了y g 硝酸钠。
(150-104)∶100=y∶300,解得y=138 g>(132-72) g
说明硝酸钠在70℃之前就已全部溶解了。
设10℃时300 g水中溶解了z g硝酸钠。
81∶100=z∶300, z=243 g
从10℃到75℃又溶解的硝酸钠:201-72=129(g)
混合物中总共含硝酸钠:243+129=372(g)。
(3)设t℃时硝酸钠恰好溶解在300 g水中,此时硝酸钠的溶解度为S g。
S∶100=372∶300, S=124 g
查硝酸钠溶解度表可得温度为60℃。故完全溶解混合物中硝酸钠所需最低温度为60℃。
4.(1)20 (2)50
5.(1)0.15 mol (2)141.4 g (3)7
6.(1)20% (2)3.93 mol/L (3)4.27 mol
7.有关反应的化学方程式:Zn+FeCl2Fe+ZnCl2
Zn+CuCl2Cu+ZnCl2
(1)根据溶液Cl-的物质的量和反应前后固体的质量变化两关系可求得Fe2+和Cu2+的量。
设FeCl2 x mol,CuCl2y mol,则有
解得:x=,
则[Cu2+]=,
[Fe2+]=。
(2)由于x+y=0.2a mol,且b g Zn粉为过量,则b≥0.2a?65 g,即b≥13a g。
(3)在Cl-的总量一定的情况下,溶液中Cu2+和Fe2+总量也一定,消耗的Zn的总量也不变,所以滤液c的质量越大,则生成的Cu越多,原溶液中CuCl2的含量越大;当原溶液中只含CuCl2时,滤渣c的质量最大。
即Fe2+=0,有b-0.2a-c=0,c=b-0.2a。
8.40.4% (12)n=1 9.(1)2,5
W、W(H2O)
W、W(Cu)
W、V(H2)
W(H2O)、W(Cu)
W(Cu)、V(H2)
(2)
10.(1)1cm3中阴、阳离子总数=()3
1cm3中Ni2+―O2-离子对数=()3×
密度=
(2)解法Ⅰ:设1 mol中含Ni3+x mol, Ni2+(0.97-x)mol。
根据电中性 3x mol +2(0.97-x)mol=2×1 mol ∴x=0.06
Ni2+为(0.97-x)mol=0.91 mol
离子数之比 Ni3+:Ni2+=0.06∶0.91=6∶91
11.(1)M(OH)2+2NaHCO3=MCO3↓+Na2CO3+2H2O (2)②
(3)M的相对原子质量为137,NaHCO3的质量58.8 g
12.(1)2CaO2CaO+O2 (2)80.0% (3)
13.(1)要求由质量、摩尔质量以及体积、浓度分别列出酸和碱的物质的量,再根据中和反应中酸碱物质的量关系列式求得碱的浓度。
∵
∴
(2)在上题求得的基础上,同样利用酸碱中和反应,求得食醋稀释液中CH3COO H的物质的量,经换算后得出C3COOH%的表示式。
∵
∵CH3COOH%=
与第(1)题相比,由于需要经过换算以及正确理解CH3COOH%的含义,所以难度略有上升。
(3)要求学生能迅速接受并理解试题给出的两个信息,据此做出判断。这两条信息是:①由第(1)上题得知,KHC8H4O4可以进一步与NaOH发生中和反应,说明KHC8H4O4溶 液呈酸性(从指示剂颜色变化可知,它与NaHCO3不同,NaHCO3是呈弱碱性的)。②0.1mol /L邻苯二甲酸(H2C8H4O4)溶液的pH大于1,说明溶液的浓度大于电离出的,证明这是弱酸,既然是弱酸,当它完全中和后生成的正盐溶液应呈弱碱性(强碱弱酸盐 水解,溶液呈弱碱性),所以,邻苯二甲酸和KOH溶液混合后,若pH=7,说明邻苯二甲酸和第 一步中和反应(生成KHC8H4O4)已完全,即>1,但第 二步中和反应(KHC8H4O4K2C8H4O4)尚不完全,即<2,现在酸和碱的体积相同,所以在1 ~2之间,即2>x>1,答案为C。
14.(1)SO2+CaCO3+O2+2H2OCaSO4?2H2O+CO 2
SO2+Ca(OH)2+O2+H2OCaSO4?2H2O
(2)=10000×0.0015×24=360(m3)=3.6×105(dm3)
=15276.86(mol)
=15267.86×100=1526786(g)=1.53×103(kg)
(3)=15267.86×172=2626071.92(g)=2.63×103
15.(1)OH-向右移动 Na+向左移动
(2)0.3C 0.3C
(3)2H2O2H2+O2?
(4)电,化学,内,Iεt-I2(R+r)t
(5)(1)0.062(6.2%);4.75mol
(6)19mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com