
题目列表(包括答案和解析)
(14分)
I、人们常利用化学反应中的能量变化为人类服务。
(1)煤是一种重要的燃料,在点燃条件下燃烧,放出大量的热。其在燃烧过程中能量的变化与如图所示中的 (填字母代号)最相符。 (2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量_____________(填“高于”或“低于”)反应后生成产物的总能量。
(2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量_____________(填“高于”或“低于”)反应后生成产物的总能量。
(3)化学反应中的能量变化不仅仅表现为热能的变化,有时还可以表现为其它形式的能量变化。比如,停电时,人们一般点蜡烛来照明,这主要是将化学能转化为 ;人们普遍使用的干电池,是将化学能转化为 。
II、某同学在超市看到一种电池外壳的纸层包装印有如获至宝图的文字,请根据要求回答问题。
(1)该电池的种类是__ ___(填序号)。[来源:Z,xx,k.Com]
①干电池 ②蓄电池 ③燃料电池
(2)该电池含有的金属元素中毒性最大的是_ __ __ (写元素符号)。
(3)该电池的使用和性能,说法正确的是__ ___
A.该电池可应用于闹钟、收音机、照相机等
B.该电池可充电后反复使用
C.该电池使用后不能投入火中,应埋入地下以防污染环境
(14分)
I、人们常利用化学反应中的能量变化为人类服务。
(1)煤是一种重要的燃料,在点燃条件下燃烧,放出大量的热。其在燃烧过程中能量的变化与如图所示中的 (填字母代号)最相符。
 (2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量_____________(填“高于”或“低于”)反应后生成产物的总能量。[来源:Zxxk.Com]
(2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量_____________(填“高于”或“低于”)反应后生成产物的总能量。[来源:Zxxk.Com]
(3)化学反应中的能量变化不仅仅表现为热能的变化,有时还可以表现为其它形式的能量变化。比如,停电时,人们一般点蜡烛来照明,这主要是将化学能转化为 ;人们普遍使用的干电池,是将化学能转化为 。
II、某同学在超市看到一种电池外壳的纸层包装印有如获至宝图的文字,请根据要求回答问题。

(1)该电池的种类是__ ___(填序号)。[来源:Z,xx,k.Com]
①干电池 ②蓄电池 ③燃料电池
(2)该电池含有的金属元素中毒性最大的是_ __ __ (写元素符号)。
(3)该电池的使用和性能,说法正确的是__ ___
A.该电池可应用于闹钟、收音机、照相机等
B.该电池可充电后反复使用
C.该电池使用后不能投入火中,应埋入地下以防污染环境
 (2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量_____________(填“高于”或“低于”)反应后生成产物的总能量。
(2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量_____________(填“高于”或“低于”)反应后生成产物的总能量。

[实验化学]
对硝基苯甲酸在医药、感光材料等工业中应用广泛。以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242 ℃,沸点约359 ℃,微溶于水,能升华。)的反应原理为: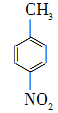 +Na2Cr2O7+4H2SO4―→
+Na2Cr2O7+4H2SO4―→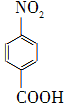 +Na2SO4+Cr2(SO4)3+5H2O
+Na2SO4+Cr2(SO4)3+5H2O
某小组以对硝基甲苯等物质为原料制取对硝基苯甲酸的实验装置如下图所示(加热和仪器固定装置均已略去),实验步骤如下:
步骤1:向250 mL三颈烧瓶中依次加入适量的对硝基甲苯、重铬酸钠粉末、水,并充分混合。在搅拌下,用滴液漏斗滴入适量浓硫酸后,加热0.5 h至反应液呈黑色。
步骤2:待反应混合物冷却后,和适量冰水充分混合,抽滤并用50 mL水分两次洗涤。将洗涤后的固体放入盛有适量5%硫酸溶液中,水浴加热10 min,冷却后抽滤。
步骤3:将抽滤后的固体溶于适量5%NaOH溶液中,50 ℃温热后抽滤,在滤液中加入少量活性炭,煮沸后趁热抽滤。将得到的滤液慢慢加入到盛有适量15%硫酸溶液的烧杯中,析出黄色沉淀,抽滤,冷水洗涤,干燥得粗产品。
(1) 在步骤1中“搅拌”是用电动搅拌器完成的,这样操作的好处有________、________。
(2) 在三颈烧瓶中,随着浓硫酸的加入,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是________。
(3) 在步骤2中,抽滤所得固体的主要成分是________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4) 步骤3用NaOH溶液进行处理的作用主要是____。
用NaOH溶液处理后,需50 ℃温热后抽滤的原因是____。
(5) 制得的粗产品需要进一步精制(纯化),根据对硝基苯甲酸的有关性质可知,对其进行精制(纯化)可以用乙醇溶液完成,也可以采用________法完成。
(一)选择题
1.B 2.D 3.B、D 4.A 5.B、D 6.C 7.B 8.C 9.D 10.C 11.2, 11.A 12.B 13.B 14.B 15.C 16.D 17.A 18.A
(二)非选择题
1.MgH2,酸足量时△1=,酸不足时 Δ1=A-1。AlH2,碱足量时Δ2=,碱不足时Δ2=B-3.
①酸碱均过量时,要使天平平衡需Δ1=Δ2,有的关系,取值范围0<A<12是对的。0<B<27是不对的,因为产生等量H2时 耗Al量比Mg少,故应由B==12.3 75,得0<B<12.375.②酸碱均不足时,并非A=B>12,应是A-1=B-3,即A=B-2,这是关 键,取值范围B>27,A>25而无上限(只需符合A=B-2)。③酸对Mg不足,碱对Al有余时,应为A-1=。取值范围怎样?酸对Mg不足,当然需A>12,这时B应由A-1=算式而定,将A>12代入知B>12.375,故B的取值范围为27>B>1 2.375.而Mg是否为27>A>12?不是的。当B<27时,A应由=A-1决 定,即=A-1得A=25,令B<27,则A<25,A的取值范围为12<A<25。④酸对Mg有余,碱对Al不足时,应有=B-3,而A<12,B>27,可见这种情况是不可能的。
2.(1)80% (2)40%
3.(1)因为在10℃、40℃、75℃时剩余固体量依次减少,所以说明10℃和40℃时溶液一定是 饱和的。
设加入的水为x.
(104-81)∶100=(201-132)∶x,解得x=300 g
(2)在75℃时,混合物中硝酸钠是否全部溶解了?设40℃到70℃时,在300g水中又溶解了y g 硝酸钠。
(150-104)∶100=y∶300,解得y=138 g>(132-72) g
说明硝酸钠在70℃之前就已全部溶解了。
设10℃时300 g水中溶解了z g硝酸钠。
81∶100=z∶300, z=243 g
从10℃到75℃又溶解的硝酸钠:201-72=129(g)
混合物中总共含硝酸钠:243+129=372(g)。
(3)设t℃时硝酸钠恰好溶解在300 g水中,此时硝酸钠的溶解度为S g。
S∶100=372∶300, S=124 g
查硝酸钠溶解度表可得温度为60℃。故完全溶解混合物中硝酸钠所需最低温度为60℃。
4.(1)20 (2)50
5.(1)0.15 mol (2)141.4 g (3)7
6.(1)20% (2)3.93 mol/L (3)4.27 mol
7.有关反应的化学方程式:Zn+FeCl2Fe+ZnCl2
Zn+CuCl2Cu+ZnCl2
(1)根据溶液Cl-的物质的量和反应前后固体的质量变化两关系可求得Fe2+和Cu2+的量。
设FeCl2 x mol,CuCl2y mol,则有
解得:x=,
则[Cu2+]=,
[Fe2+]=。
(2)由于x+y=0.2a mol,且b g Zn粉为过量,则b≥0.2a?65 g,即b≥13a g。
(3)在Cl-的总量一定的情况下,溶液中Cu2+和Fe2+总量也一定,消耗的Zn的总量也不变,所以滤液c的质量越大,则生成的Cu越多,原溶液中CuCl2的含量越大;当原溶液中只含CuCl2时,滤渣c的质量最大。
即Fe2+=0,有b-0.2a-c=0,c=b-0.2a。
8.40.4% (12)n=1 9.(1)2,5
W、W(H2O)
W、W(Cu)
W、V(H2)
W(H2O)、W(Cu)
W(Cu)、V(H2)
(2)
10.(1)1cm3中阴、阳离子总数=()3
1cm3中Ni2+―O2-离子对数=()3×
密度=
(2)解法Ⅰ:设1 mol中含Ni3+x mol, Ni2+(0.97-x)mol。
根据电中性 3x mol +2(0.97-x)mol=2×1 mol ∴x=0.06
Ni2+为(0.97-x)mol=0.91 mol
离子数之比 Ni3+:Ni2+=0.06∶0.91=6∶91
11.(1)M(OH)2+2NaHCO3=MCO3↓+Na2CO3+2H2O (2)②
(3)M的相对原子质量为137,NaHCO3的质量58.8 g
12.(1)2CaO2CaO+O2 (2)80.0% (3)
13.(1)要求由质量、摩尔质量以及体积、浓度分别列出酸和碱的物质的量,再根据中和反应中酸碱物质的量关系列式求得碱的浓度。
∵
∴
(2)在上题求得的基础上,同样利用酸碱中和反应,求得食醋稀释液中CH3COO H的物质的量,经换算后得出C3COOH%的表示式。
∵
∵CH3COOH%=
与第(1)题相比,由于需要经过换算以及正确理解CH3COOH%的含义,所以难度略有上升。
(3)要求学生能迅速接受并理解试题给出的两个信息,据此做出判断。这两条信息是:①由第(1)上题得知,KHC8H4O4可以进一步与NaOH发生中和反应,说明KHC8H4O4溶 液呈酸性(从指示剂颜色变化可知,它与NaHCO3不同,NaHCO3是呈弱碱性的)。②0.1mol /L邻苯二甲酸(H2C8H4O4)溶液的pH大于1,说明溶液的浓度大于电离出的,证明这是弱酸,既然是弱酸,当它完全中和后生成的正盐溶液应呈弱碱性(强碱弱酸盐 水解,溶液呈弱碱性),所以,邻苯二甲酸和KOH溶液混合后,若pH=7,说明邻苯二甲酸和第 一步中和反应(生成KHC8H4O4)已完全,即>1,但第 二步中和反应(KHC8H4O4K2C8H4O4)尚不完全,即<2,现在酸和碱的体积相同,所以在1 ~2之间,即2>x>1,答案为C。
14.(1)SO2+CaCO3+O2+2H2OCaSO4?2H2O+CO 2
SO2+Ca(OH)2+O2+H2OCaSO4?2H2O
(2)=10000×0.0015×24=360(m3)=3.6×105(dm3)
=15276.86(mol)
=15267.86×100=1526786(g)=1.53×103(kg)
(3)=15267.86×172=2626071.92(g)=2.63×103
15.(1)OH-向右移动 Na+向左移动
(2)0.3C 0.3C
(3)2H2O2H2+O2?
(4)电,化学,内,Iεt-I2(R+r)t
(5)(1)0.062(6.2%);4.75mol
(6)19mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com