
题目列表(包括答案和解析)
超音速飞机在平流层飞行时,尾气中的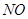 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的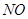 和
和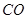 转变成
转变成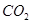 和
和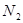 ,化学方程式:2NO+2CO
,化学方程式:2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度(mol·L-1)如表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的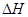 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=_____________。(保留两位小数)
(3)下列措施能提高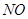 和
和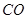 转变成
转变成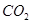 和
和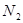 的反应速率的是 。
的反应速率的是 。
A.选用更有效催化剂 B.升高反应体系温度C.降低反应体系温度 D.缩小容器体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。(浓度/ mol·L-1)
|
实验编号 |
T/℃ |
NO初始浓度 |
CO初始浓度 |
催化剂比表面积/m2·g-1 |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
|
|
|
124 |
|
Ⅲ |
350 |
|
|
124 |
①请在上表格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号、起始浓度。
对于平衡体系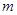 A(g)+
A(g)+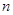 B(g)
B(g)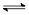
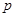 C(g)+
C(g)+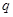 D(g) ΔH <0,下列结论中不正确的是
D(g) ΔH <0,下列结论中不正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则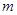 +
+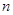 <
<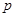 +
+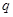
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为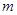 ∶
∶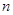
C.若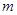 +
+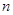 =
=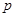 +
+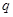 ,则往含有
,则往含有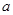 mol气体的平衡体系中再加入
mol气体的平衡体系中再加入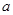 mol的B,达到新平衡时,气体的总物质的量等于2
mol的B,达到新平衡时,气体的总物质的量等于2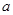
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
超音速飞机在平流层飞行时,尾气中的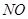 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的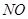 和
和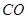 转变成
转变成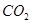 和
和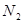 ,化学方程式:2NO+2CO
,化学方程式:2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度(mol·L-1)如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
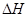 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。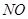 和
和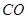 转变成
转变成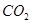 和
和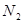 的反应速率的是 。
的反应速率的是 。| 实验编号 | T/℃ | NO初始浓度 | CO初始浓度 | 催化剂比表面积/m2·g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | | | | 124 |
| Ⅲ | 350 | | | 124 |
对于平衡体系mA(g)+ nB(g)![]() pC(g)+ qD(g) ΔH<0。下列结论中不正确的是
pC(g)+ qD(g) ΔH<0。下列结论中不正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
一、单项选择题(本题包括8小题,每题3分,共24分。)
1.C 2.C 3.D 4.A 5.A 6.D 7.B 8.B
二、不定项选择题(本题包括6小题,每小题4分,共24分。)
9.BD 10.A 11.D 12.BD 13.BC 14.D
三、非选择题(本题包括6小题,共60分)
15、(10分)
(1)Fe2+ (1分)
(2)4FeCO3+O22Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
(3)K2SO4 (1分) 蒸发结晶、洗涤(2分)
(4)滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液。(2分)
16.(8分) ⑴Cu、O; ⑵b、c;
⑶2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=2SO42-+2Fe3+;
⑷a: Al3++4OH-=AlO2-+2H2O[或Al3++4OH-=Al(OH)4-];
b:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
17、(12分)
(1)四 (1分) ⅥB (1分)
(2)① Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O (2分)
② Cr3+ + 4OH- = CrO2- + 2H2O (2分)
③ 8~10 (1分) ④ ABCD (2分)
(3)① 符合 (1分)
② (以下任意2条即可)(2分)
其它条件相同时,含铬废渣掺入的比例越大,Cr元素浸出的浓度越高;
酸性环境对Cr元素浸出有抑制作用;
冻融对Cr元素浸出影响不明显;或曝晒对Cr元素浸出影响不明显;
18、(10分)
(1)0.3 mol/(L?min) 升高温度
(2)
(3)-41.2 kJ/mol a
19、(12分)
(1)4
(2) 还原反应
(3)、
(4)
20.(10分)
⑴ ①
② 解:(C6H10O5)n~n C6H12O6~2nC2H5OH~nCH3COOC2H5
162n 88n
1000kg×90%×85%×90%×90% m(CH3COOC2H5)
m(CH3COOC2H5)=374 kg
⑵ 解:[(C6H7O2)(OH)3]n~[(C6H7O2)(OH)(3-x)(OOCCH3)x]n △m
162n 162n+42nx 42nx
10g 15.19g 5.19g
= x=2
故该醋酸纤维的结构简式为[(C6H7O2)(OH)(OOCCH3)2]n
四、选做题(本题包括1小题,共12分)
21.(12分)
A.⑴ O>N>C 1s22s22p63s23p63d84s2
⑵ 顺铂易溶于水,因为它是极性分子,易溶于极性溶剂
⑶ 4
⑷ ① ② sp3和sp2
 江苏省金湖中学2009届高三化学周练答题纸
江苏省金湖中学2009届高三化学周练答题纸
(本卷满分120分,考试时间100分钟)
第Ⅰ卷
选择题
1
2
3
4
5
6
7
8
9
10
11
12
13
14
――
――
――
――
非选择题
答题说明:除作图可使用2B铅笔外,其余各题请按题号用0.5mm黑色签字笔书写,否则作答无效。
非选择题(共72分)
15.(10分)
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)化学反应方程式为____________________________。
_________、_________。
(3)产品Ⅱ的化学式为_______________,
操作是: __ 、趁热过滤、 __ 、干燥。
(4) ______
______________________________________________ 。
16.(8分)
(1) ( 填元素符号);
(2) (填代号)。
(3) 、
(不必配平);
(4)a.除去Al3+的离子方程式是 。
b.所选试剂为 。
实验现象为 。
请在各题规定的矩形区域内答题,超出该区域的答案无效!
17.(12分)
(1)第_______周期_______族。
(2)① 离子方程式为_________________________________________________。
② 离子方程式为_________________________________________________。
③ pH应控制在 范围内。
④ 说法中正确的是 。
(3)① 实验取用的砖样是否符合上述标准: 。
② 还能得出的其它结论是(写出2条即可):
_______________________________________________________________;
_______________________________________________________________。
18. (10分)
(1)v(H2)= 。 改变的外界条件可能是 。
(2)
(3) 。
19. (12分)
(1) 。 (2) ; 。
(3)、 、 。
(4)
请在各题规定的矩形区域内答题,超出该区域的答案无效!
20、(8分)
(1)①五元环结构为 。
②
(2)
四、选做题:
21、(12分)
(1)C、N、O三种元素的电负性由大到小的顺序是 ;
Ni元素基态原子的电子排布式: 。
(2)理由: 。
(3)含有 个铂原子。
(4)① 化合物X的结构式为 (必须标明配位键)。
② 化合物X、Y分子中,N元素分别发生了 杂化。
请在各题规定的矩形区域内答题,超出该区域的答案无效!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com