
题目列表(包括答案和解析)
木炭在氧气中燃烧比在空气中燃烧得更旺;夏天,将食品放在冰箱里不容易腐烂。说明反应物的浓度和温度对化学反应快慢(反应速率)有影响。那么,浓度和温度是如何影响化学反应速率的?
设计方案:同学们利用双氧水和二氧化锰反应来探究上述问题,设计了下列3组实验。其中二氧化锰的作用是 。
| 组别 | 温度 | 二氧化锰的质量 | 双氧水的浓度和体积 | 观察产生气泡的速率 |
| 1 | 室温 | 0.5g | 5%、50 mL | 反应平稳,有大量气泡产生 |
| 2 | 加热 | 0.5g | 5%、50 mL | 气泡急速产生,并产生大量白雾 |
| 3 | 室温 | 0.5g | 30%、50 mL | 气泡呈爆发式产生,并带出反应液 |
分析探究:哪两组实验用来探究浓度对化学反应速率的影响? 。
通过上述实验得出的结论是:
① 、
② 。
讨论反思:通过三组实验的观察与比较,你认为第 组方案比较适合在实验室制取氧气。写出发生反应的化学方程式 。
| 编号 | 氯酸钾的质量 | 其他物质质量 | 待测数据 |
| 1 | 2.0克 | 不加任何物质 | … |
| 2 | 2.0克 | 氧化铜0.5克 | … |
| 3 | 2.0克 | 二氧化锰 0.5克 | … |
| 质量 分数 |
0% (纯水) |
1% | 4% | 10% | 16% | 24% | 32% | 36% | 44% | 49% | 60% | 98% |
| 密度 | 1.00 | 1.01 | 1.02 | 1.07 | 1.11 | 1.17 | 1.24 | 1.27 | 1.34 | 1.39 | 1.50 | 1.84 |

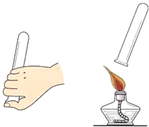
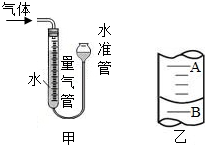
| 编号 | KClO3质量(g) | 其他物质质量(g) | 待测数据 |
| 1 | 2.0 | / | |
| 2 | 2.0 | CuO 0.5 | |
| 3 | 2.0 | MnO2 0.5 |
| 实验步骤 | 设计这一步骤的目的 |
| 实验表明,加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com