
题目列表(包括答案和解析)
| 装置 | 反应前 | 反应后 |
| A | 试管的质量38.2 克 氧化铜和炭粉混合物的质量20.0克 |
试管和固体物质的质量56.8 克 |
| B | 反应后瓶内石灰水比反应前增重1.1 克 | |
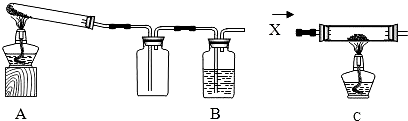
| 某课外活动小组的同学将过量的炭粉和16克氧化铜均匀混合,用下图所示装置进行实验。图中铁架台等装置已略去。请回答有关问题: | ||
 | ||
| (1)同学们想通过测定消耗碳、氧元素的质量和生成二氧化碳的质量,分析氧化铜和炭粉反应产生的气体除CO2外是否还有其它产物。反应一段时间后停止加热,冷却到室温。反应前、后测得的数据如下: | ||
 | ||
| 分析数据发现,反应中消耗碳和氧元素的质量 (填“大于”、“小于”或“等于”)生成二氧化碳的质量。下列4项中跟这一结果有关的有哪几项? 。(填写字母) A.装置中还有一部分CO2未被石灰水溶液吸收 B.氧化铜和炭粉反应产生的气体除CO2外还有CO C.氧化铜和炭粉没有完全反应 D.该反应不符合质量守恒定律 | ||
|

| 装置 | 反应前 | 反应后 |
| A | 试管的质量38.2 克 氧化铜和炭粉混合物的质量20.0克 | 试管和固体物质的质量56.8 克 |
| B | 反应后瓶内石灰水比反应前增重1.1 克 | |
| |||||||||||||||
测定溶解度有多种方法,下列是测定30℃时硫酸铜溶解度的实验方法。经查找资料,30℃时硫酸铜的溶解度为25g/100gH2O。
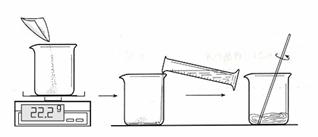 一、配置30℃时的硫酸铜饱和溶液:
一、配置30℃时的硫酸铜饱和溶液:
①配置的步骤如图:
取用100mL水,图中称量得到22.2g硫酸铜用于实验,是否合理,请说出理由(9) ;并在30℃的水浴中加热硫酸铜溶液一段时间,保证硫酸铜完全溶解,得到饱和溶液。
二、测量一定质量饱和硫酸铜溶液中硫酸铜的质量:
②在已配得的30℃时饱和溶液中,迅速取出饱和溶液50g,采用蒸发的方法求得硫酸铜的质量。从饱和溶液中析出蓝色晶体的化学式为(10) ,得到晶体后还要继续加热,直至固体颜色变为(11) 色为止。此操作过 程中,用到的仪器除铁架台、酒精灯外,还需(12) 。
程中,用到的仪器除铁架台、酒精灯外,还需(12) 。
③最后称量得到固体质量为9.8g,经计算得到此时硫酸铜的溶解度为(13) g/100gH2O(精确到0.1g)。实验反思:实验数值比资料中的数据偏小,可能的原因是(14)
(写出一条即可);
④测量50g饱和硫酸铜溶液中硫酸铜的质量,还可以使用重量法。
实验原理:CuSO4+BaCl2 →CuCl2+BaSO4↓
该实验 方法中一定还要用到的实验操作是(15) (填写操作名称)。若最终得到硫酸钡14.5g,计算溶液中硫酸铜的质量为多少克?(提示:硫酸铜式量为160,硫酸钡式量为233。写出计算过程,精确到0.1g)
方法中一定还要用到的实验操作是(15) (填写操作名称)。若最终得到硫酸钡14.5g,计算溶液中硫酸铜的质量为多少克?(提示:硫酸铜式量为160,硫酸钡式量为233。写出计算过程,精确到0.1g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com