
题目列表(包括答案和解析)
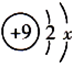 ,其中x为
,其中x为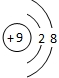
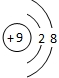
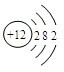 元素周期表是我们学习和研究化学的重要工具,它的内容十分丰富.下面是元素周期表部分内容,请回答下列问题:
元素周期表是我们学习和研究化学的重要工具,它的内容十分丰富.下面是元素周期表部分内容,请回答下列问题:| 1 H 氢 |
2 He 氦 | ||||||
| 3 Li 锂 |
4 Be 铍? |
5 B? 硼 |
6 C? 碳 |
7 N? 氮 |
8 O? 氧 |
9 F? 氟 |
10 Ne? 氖 |
| 11 Na ?钠? |
12 Mg ? |
13 A1 ?铝? |
14 Si ?硅 |
15 P ?磷 |
16 S ?硫 |
17 Cl? 氯 |
18 Ar? 氩 |
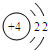 B.
B.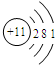 C.
C.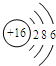 D.
D.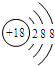
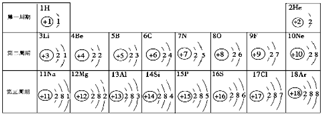 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
| 族 周期 |
IA | 0 | ||||||
| 一 | 1 H 1.008 |
ⅡA | ⅢA | ⅣA | V A | ⅥA | ⅦA | 2 He 4.003 |
| 二 | 3 Li 6.941 |
4 Be 9.012 |
5 B 10.8l |
6 C 12.01 |
7 N 14.0l |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 |
| 三 | 11 Na 22.99 |
12 Mg 24.31 |
13 Al 26.98 |
14 Si 28.09 |
15 P 30.97 |
16 S 32.06 |
17 Cl 35.45 |
18 Ar 39.95 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com