
题目列表(包括答案和解析)
 将X溶液滴入Y溶液中,在滴加过程中,Y溶液
将X溶液滴入Y溶液中,在滴加过程中,Y溶液| 溶液 | A | B | C | D |
| X | 盐酸 | 氢氧化钠 | 盐酸 | 氢氧化钠 |
| Y | 水 | 水 | 氢氧化钠 | 盐酸 |
将V1mL3.65% HCl溶液逐滴滴入盛有V2mL未知浓度的
NaOH溶液的烧杯中(图1),测量并记录溶液的pH变化(图2)和
温度变化(图3)。(实验中始终保持 V1+V2=50.0mL且各种溶液密度
均为1.0g/mL)。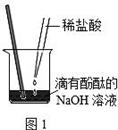
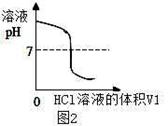
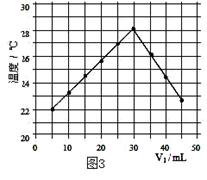
(1)图2中V1="0" mL时,图1中烧杯内溶液的颜色显 色;
(2)实验中发生反应的化学方程式为 ;
(3)图2中的pH=7时,此时滴入的HCl溶液的体积V1= mL;
(4)通过该实验给出的判断,其中正确的是 ;
| A.进行该实验时环境温度为22℃ |
| B.该实验表明化学能可转化为热能 |
| C.该实验表明有水生成的反应都是放热反应 |
| D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱 |



| A.进行该实验时环境温度为22℃ |
| B.该实验表明化学能可转化为热能 |
| C.该实验表明有水生成的反应都是放热反应 |
| D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱 |
(9分)某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯
中的氢氧化钙溶液加入稀盐酸一会儿后,发现忘记了滴加指示剂。因此,他们停止滴
加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式: 。
Ⅱ、探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;
猜想三: 。
【查阅资料】氯化钙溶液呈中性。
【进行实验】实验步骤1:取少量烧杯内溶液加入试管中,滴加几滴酚酞溶液,振荡。
实验现象1: 。结论:猜想一不正确。
实验步骤2:取少量烧杯内溶液加入另一支试管中,逐滴加入碳酸钠溶液至过量。
实验现象2: 。结论:猜想二不正确,猜想三正确。
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 。
(2)验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质或方法单独使用也能完成该实验? (填序号)
a.pH试纸 b.检查导电性 c.镁条 d.硝酸银溶液
(3)要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com