
题目列表(包括答案和解析)
根据下列装置图回答问题。

Ⅰ.写出仪器①的名称是 ⑻ ,仪器②的名称 ⑼ 。
Ⅱ.实验室用一定质量的氯 酸钾制取氧气,通过排水量测定所收集到的氧气体积。
酸钾制取氧气,通过排水量测定所收集到的氧气体积。
①写出该反应的化学方程式 ⑽ 。
②若各装置的连接顺序是:a→b→c→d,H装置内导管(“b”或“c”)该怎样延伸?请画出⑾ 。
③根据氯酸钾的质量算出的氧气体积为理论值.如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因是 ⑿ 。
Ⅲ.某兴趣小组为了选择实验室制取二氧化碳的原料,对影响盐酸与大理石(大理石中杂质不与盐酸反应)反应的速率快慢的因素展开研究。
提出假设:盐酸与大理石反应的速率快慢与所用HCl的质量分数、大理石颗粒大小有关。
实验设计与实施:
| 实验编号 | 温度 | 5克大理石(碳酸钙纯度相同)规格 | 20克HCl的质量分数 | 完全反应所需时间/s |
| 实验① | 20℃ | 粗颗粒 | 20% | 140 |
| 实验② | 20℃ | 粗颗粒 | 10% | 220 |
| 实验③ | 20℃ | 细颗粒 | 20% | 30 |
根据以上信息回答下列问题:
写出上述实验中反应的化学方程式 ⒀ 。
实验①与②的目的是为了探究 ⒁ 。
实验 ⒂ (填实验编号)的目的是为了探究大理石颗粒粗、细对反应快慢的影响。
实验结论:HCl质量分数越大,反应越快;固体的颗粒越小,反应越快。
拓展与反思:还有哪些因素可能影响该反应的速率快慢呢?请写出你的一个猜想: ⒃ 。
根据上述实验探究,实验室选用块状大理石与稀盐酸制取二氧化碳,选用上图中具有启普发生器原理 的 ⒄ (填编号)装置作为制取二氧化碳的发生装置。
的 ⒄ (填编号)装置作为制取二氧化碳的发生装置。
Ⅳ.实验室在常温下用块状电石固体与水反应制取乙炔气体, 该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体。上图中制取较纯乙炔的最适宜发生和收集装置是 ⒅ (填编号,除装置H和I外)。
该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体。上图中制取较纯乙炔的最适宜发生和收集装置是 ⒅ (填编号,除装置H和I外)。
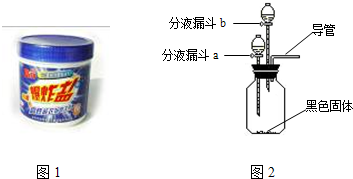
| 序号 | 主要操作步骤 | 主要实验现象 | 化学反应方程式 | |
| ① | 在集气瓶中加入少量 |
|||
| ② | 打开分液漏斗a的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | ||
| 然后 |
||||
| 第②步操作得到的结论:“污渍爆炸盐”溶于水生成过氧化氢 | ||||
| ③ | 待②步反应停止后,打开分液漏斗b的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | ||
| 将生成的气体通入 |
验证生成气体的成分. | |||
| 第③步操作得到的结论:“污渍爆炸盐”溶于水生成碳酸钠 | ||||
|
某校化学兴趣小组参观制碱厂后获得以下信息,并对相关问题进行研究。 | ||||||
 | ||||||
| 上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH==Mg(OH)2↓ +2NaCl;Na2CO3+CaCl2==CaCO3↓+2NaCl;NH4Cl==NH3↑+HCl↑。生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O==NaHCO3(晶体)↓+NH4Cl4分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为______________________________________________。 【问题讨论】(2)溶液A中的溶质为________,操作Ⅱ的名称为_____________。 (3)上述生产流程中可循环使用的是____ (填序号)。 A.CO2;B.NH3;C.HCl;D.NaOH;E.Na2CO3 (4)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠: | ||||||
| ||||||
|
【含量测定】同学们为了测定该纯碱样品的纯度,设计了如下实验。 | ||||||
 |
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【查阅资料】
<资料1> 该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵。(“侯氏制碱法”
是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺。)
<资料2> 生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
<资料3> 部分生产流程如下图所示。

上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH= ▲ ↓+2NaCl;
![]() Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl;NH4Cl== NH3↑+HCl↑
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl;NH4Cl== NH3↑+HCl↑
<资料4>生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵
的混合物,其反应的化学方程式为:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl;分
离出固体产物,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方
程式为 ▲ 。
【问题讨论】
(1)溶液A中的溶质为 ▲ ,操作Ⅱ的名称为 ▲ 。
(2)上述生产流程中可循环使用的是 ▲ (填序号)。
A. CO2 B. NH3 C. HCl D.NaOH E. Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠。
| 实验步骤 | 实验现象 | 实验结论 |
| ▲ | ▲ | ▲ |
【含量测定】
研究小组的同学们为了测定该纯碱样品的纯度,设计了如下实验。
甲组:
取10.0 g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,
直至样品中无气泡冒出。充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9 g。样品中碳酸钠的质量分数为 ▲ (结果保留一位小数)。
乙组:
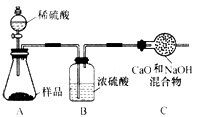
取10.0 g纯碱样品,利用右图所示装置,测出反应
后装置C增重了3.5 g(所加试剂均足量)。实验结束后,发现乙组测定的质量分数偏小,
其原因是 ▲ 。

| 清洁剂 | 彩漂液 | 漂白水 |
| 功 能 | 漂洗衣物,使色彩鲜艳 | 漂除衣物污渍 |
| 有效成分 | H2O2 | NaClO |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com