
题目列表(包括答案和解析)
 (2007?湘潭)在我国某地区有一种“冬天捞碱,夏天晒盐”的说法.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量的NaCl.
(2007?湘潭)在我国某地区有一种“冬天捞碱,夏天晒盐”的说法.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量的NaCl.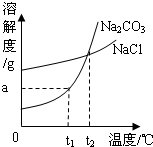 在我国某地区有一种“冬天捞碱,夏天晒盐”的说法.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量的NaCl.
在我国某地区有一种“冬天捞碱,夏天晒盐”的说法.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量的NaCl.我国某地区有一种“冬天捞碱,夏天晒盐”的说法,这里的“碱”是指Na2CO3,“盐”是指NaCl。这样捞得的“碱”中含有少量NaCl。某化学课外活动小组为了解释捞碱、晒盐的原理和测定“碱”样品中Na2CO3的含量进行了以下探究。
[查阅资料]
Na2CO3和NaCl的溶解度曲线如图所示。
(1)根据图示回答:①t1 ℃时Na2CO3的溶解度为________ g;t2 ℃时Na2CO3的溶解度________(填“>”“=”或“<”)NaCl的溶解度。
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度的降低而________(填“增大”“减小”或“不变”)。
③“夏天晒盐”是利用________(填字母)的方法,使NaCl晶体析出。

A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl的溶解度增大
[实验步骤]
第一步:称取34.6 g“碱”样品。
第二步:将该样品放入13 0 g稀盐酸中,两者恰好完全反应。其化学方程式为Na2CO3+2HCl===2NaCl+H2O+CO2↑
0 g稀盐酸中,两者恰好完全反应。其化学方程式为Na2CO3+2HCl===2NaCl+H2O+CO2↑
第三步:完全反应后,称得溶液的总质量为151.4 g,经计算可知释放出的二氧化碳的质量为13.2 g。
[数据分析]
(2)试计算:(结果保留一位小数)
①Na2CO3的相对分子质量。②34.6 g“碱”样品中碳酸钠的质量。③“碱”样品中Na2CO3的纯度。
[继续探究]
(3)计算反应后所得溶液中NaCl的质量分数。
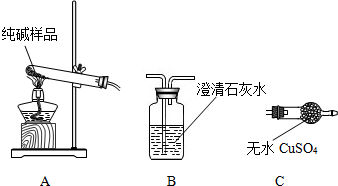
| ||

| ||
| ||
| 选择的装置 | 实验现象 | 实验结论 |
AB”或“AC”或“ACB AB”或“AC”或“ACB |
“B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” “B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” |
样品不含晶体A |
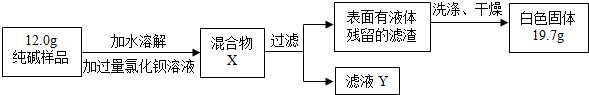
| 106 |
| X |
| 197 |
| 19.7g |
| 10.6g |
| 12.0g |
| 106 |
| X |
| 197 |
| 19.7g |
| 10.6g |
| 12.0g |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com