
题目列表(包括答案和解析)
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。根据下表中短周期元素的原子半径和主要化合价,回答表后的问题。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
⑴ 上述元素中与元素⑧处于同一周期的有______________________(填元素符号)
⑵ 元素①在元素周期表中的位置是_______________________
⑶ ①④⑦三种元素的氢化物的稳定性由强到弱的顺序为__________________(填化学式)
⑷ 元素④构成的两种单质互称为_____________(填“同位素”、“同素异形体”或“同分异构体”)
⑸ 请写出下列元素形成的常见化合物的电子式:
③⑤_____________ ②⑤_____________ ③⑦_____________
⑹ 工业制备⑧的过程中,被电解的物质是_____________(填化学式),属于_____________(填“离子”或“共价”)化合物
⑺ 请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式:
___________________________________________________________________
二氧化铈![]() 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含![]() 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
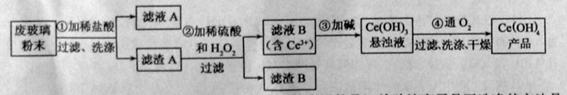
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗涤的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的![]()
![]() 产品0.536g,加硫酸溶解后,用0.1000mol•
产品0.536g,加硫酸溶解后,用0.1000mol•![]() 标准溶液滴定终点是(铈被还原为
标准溶液滴定终点是(铈被还原为![]() ),消耗25.00mL标准溶液,该产品中
),消耗25.00mL标准溶液,该产品中![]() 的质量分数为 。
的质量分数为 。
二氧化铈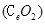 是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含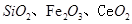 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: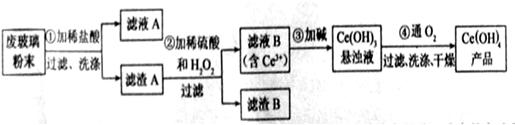
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗净的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
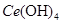 产品0.536g,加硫酸溶解后,用0.1000mol?
产品0.536g,加硫酸溶解后,用0.1000mol?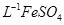 溶液(铈被还原为
溶液(铈被还原为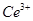 ),消耗25.00mL溶液,该产品中
),消耗25.00mL溶液,该产品中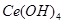 的质量分数为 。
的质量分数为 。
二氧化铈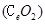 是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含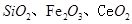 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
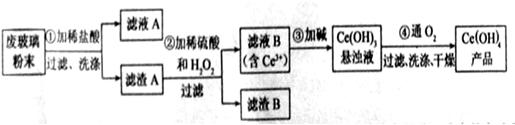
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗净的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
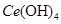 产品0.536g,加硫酸溶解后,用0.1000mol?
产品0.536g,加硫酸溶解后,用0.1000mol?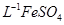 溶液(铈被还原为
溶液(铈被还原为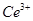 ),消耗25.00mL溶液,该产品中
),消耗25.00mL溶液,该产品中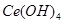 的质量分数为 。
的质量分数为 。
| ||
14.C 15.A 16.B 17.D 18. BC 19. D 20. ACD 21. ACD
22.(18分)
(1)(6分)(1)0.70 (2分) 2)24(2分) 小于(2分)
(2)(12分)
① 200.files/image111.gif) ; 2分
; 2分
② .files/image113.gif) ;
; .files/image079.gif) 3分
3分
.files/image115.jpg) ③ 如图所示(有错不给分,但图中电压表选
③ 如图所示(有错不给分,但图中电压表选.files/image117.gif) 或电流表选
或电流表选.files/image119.gif) ,不重复扣分)4分
,不重复扣分)4分
④ 3分
.files/image120.jpg)
23.(14分)
|