

 |
 pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。
(1)据图1所示,反应开始至达到平衡时,用D表示该反应速率为_____;
(2)该反应的化学平衡常数K的数值为_________________(保留至两位小数);
(3) 下列措施能增大B的转化率的是
A.再投入2molA和1molB B.保持体积不变通入1molB
24、 (12分) 在某个容积为
23、(8分)保持洁净安全的生存环境已成为全人类的共识。
(1)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行 。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 。
(2)用生物处理的方法除去废水中的氮是先将大多数有机态氮转化为氨态氮,然后通过进一步转化成N2而消除污染。其中一种方法的部分反应过程为如下。
2NH4++3O2==2HNO2 +2H2O +2H+ 2HNO2 +O2===2HNO3
①NH4+的空间构型为 。
②上述方法中氨态氮元素
③荷兰科学家发现了一种新方法:在厌氧条件下,以亚硝酸盐作为氧化剂,在自养菌作用下将氨态氮(氨态氮以NH4+表示)氧化为氮气。其反应离子方程式为 。
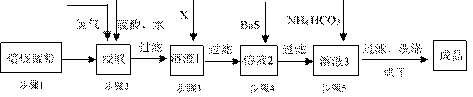
②步骤3是除去杂质Fe2+。请用文字和必要的方程式简述除去Fe2+的方法 (已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6 。)
___________________________________________________________________________。
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是______________________________________________。
(4) 已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为 。
试回答下列问题
(1)锰在元素周期表中第 周期,第 族。
(2)步骤1和步骤2是将MnO2等转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式 。
(3) 步骤3和步骤4都是除杂质
①X是一种“绿色”氧化剂,则X是____________(填化学式)。
22.(12分) 锌锰废电池经处理后,生产并回收硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:

Na2S2O3溶液呈中性,能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
操作二:
S2O32―+2H+=S↓+SO2↑+H2O
猜想③
操作三:
(3)小组同学为确证经操作三后Na2S2O3被氧化,提出如下实验方案________________________________________________________________________________________________________________________________________________________________________________。
21、(11分) 硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。研究小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
(1)他们提出如下猜想:猜想①:与BaCl2溶液反应有沉淀生成;猜想②:溶液呈中性,且不与酸反应;猜想③:无还原性,不能被氧化剂氧化。
他们提出上述猜想的依据是__________________________________________________。
(2)对上述猜想②、③,他们设计实验方案,并进行实验。请在答题卡上按下表格式完成相关的实验操作步骤、预期现象。请限选实验仪器与试剂:试管、玻璃棒、滴管、pH试纸:3 mol?L-1H2SO4、新制氯水、1 mol?L-1 BaCl2 溶液、Na2S2O3溶液、蒸馏水。
实验操作
实验现象或
预期实验现象
现象解释
(用离子方程式表示)
结论
猜想②
操作一:
溶液pH=8
②通过以上数据,得出
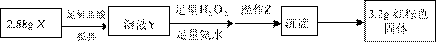
①操作Z是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com