
2. 放电(原电池)时,先要确定氧化剂和正极、还原剂和负极。充电(电解池)时,放电时的正极变为电解池的阳极,与外电源正极相连;放电时的负极变为电解池的阴极,与外电源负极相连。正极反应式颠倒即为阳极反应式,负极反应式颠倒即为阴极反应式。
铅蓄电池(正极:PbO2,负极:Pb,电解质:H2SO4溶液)
铅蓄电池的充、放电过程:Pb(s)+PbO2(s)+2H2SO4(aq)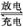 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
(1) 放电过程
负极:Pb(s)+S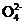 (aq)-2e-
(aq)-2e- PbSO4(s) (氧化反应)
PbSO4(s) (氧化反应)
正极:PbO2(s)+4H+(aq)+S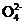 (aq)+2e-
(aq)+2e- PbSO4(s)+2H2O(l) (还原反应)
PbSO4(s)+2H2O(l) (还原反应)
放电过程总反应:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
(2) 充电过程(是放电过程的逆过程)
阴极:PbSO4(s)+2e- Pb(s)+S
Pb(s)+S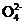 (aq) (接电源负极,还原反应)
(aq) (接电源负极,还原反应)
阳极:PbSO4(s)+2H2O(l)-2e- PbO2(s)+4H+(aq)+S
PbO2(s)+4H+(aq)+S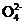 (aq) (接电源正极,氧化反应)
(aq) (接电源正极,氧化反应)
充电过程总反应:2PbSO4(s)+2H2O(l) Pb(s)+PbO2(s)+2H2SO4(aq)
Pb(s)+PbO2(s)+2H2SO4(aq)

趁热打铁,事半功倍。请同学们及时完成《配套检测与评估》中的练习第167-169页。
第二篇 化学反应原理
专题五 反应热 电化学
[高考回眸]
1. (1) 正、负(阴、阳)极反应式中的电子得失数目保持相等。
(2) 看电极反应生成的离子与电解质溶液中的离子能否共存,若不能共存,则该电解质溶液中的离子也要写入电极反应式中。
(3) 要注意电解质溶液的酸碱性。当正极上的反应物质为O2时,若溶液显碱性或中性,电极反应式中不能出现H+,电极反应式为O2+2H2O+4e- 4OH-;若溶液显酸性,电极反应式中不能出现OH-,电极反应式为O2+4H++4e-
4OH-;若溶液显酸性,电极反应式中不能出现OH-,电极反应式为O2+4H++4e- 2H2O。
2H2O。
(4) 电池反应方程式是正、负(阴、阳)极电极反应式相加的结果,反过来也可以用电池反应方程式减去已知的任一电极的电极反应式就得到另一电极的电极反应式。另外,写好反应式后,还要检查是否符合质量守恒、电荷守恒和得失电子守恒等规律。
4. (双选)(2013·揭阳一中期初)Li-SOCl2电池可用于心脏起搏器。电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2 4LiCl+S+SO2。电池工作时,下列说法正确的是( )
4LiCl+S+SO2。电池工作时,下列说法正确的是( )
A. 锂电极发生还原反应
B. 电子通过外电路从锂电极流向碳电极
C. 每生成1molSO2转移4mol电子
D. SOCl2既是氧化剂又是还原剂
[问题思考]提示
3. (2013·韶关一模改编)下列有关金属腐蚀与防护的说法正确的是( )
A. 亚运会纯银奖牌表面在空气中因化学腐蚀渐渐变暗
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 在远洋货轮外壳连接铜块保护外壳不受腐蚀
D. 西气东输时,地下钢管与外加直流电源的正极相连以保护它不受腐蚀
2. (2013·佛山二模改编)某志愿者在广州亚运会设计了一个“中国必胜”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
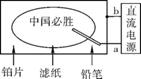
A. 铅笔端作阳极,发生还原反应
B. 铂片端作阴极,发生氧化反应
C. 铅笔端有少量的氯气产生
D. a点是负极,b点是正极
1. (2013·江门二模改编)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g) 2NO2(g) ΔH=+67.7kJ·mol-1
2NO2(g) ΔH=+67.7kJ·mol-1
2N2H4(g)+2NO2(g) 3N2(g)+4H2O(g) ΔH=-1135.7kJ·mol-1
3N2(g)+4H2O(g) ΔH=-1135.7kJ·mol-1
下列说法正确的是( )
A. N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-1068kJ·mol-1
N2(g)+2H2O(g) ΔH=-1068kJ·mol-1
B. 肼是与氨类似的弱碱,它易溶于水,其电离方程式为N2H4+H2O N2
N2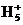 +OH-
+OH-
C.铂作电极,以KOH溶液为电解质溶液的肼-空气燃料电池,放电时的负极反应式为N2H4-4e-+4OH- N2+4H2O
N2+4H2O
D. 铂作电极,以KOH溶液为电解质溶液的肼-空气燃料电池,工作一段时间后,KOH溶液的pH将增大
4. (双选)(2013·湛江月考)下列关于各装置图的叙述不正确的是( )
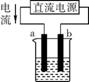
①
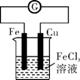
②
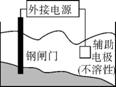
③
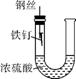
④
A. 用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液
B. 装置②的总反应是Cu+2Fe3+ Cu2++2Fe2+
Cu2++2Fe2+
C. 装置③中钢闸门应与外接电源的负极相连
D. 装置④中的铁钉几乎没被腐蚀

|
1. 电极反应式、电池反应方程式的书写应注意哪些问题 |
|
2. 如何判断二次电池充电和放电的氧化还原问题请以铅蓄电池的充、放电过程为例说明。 |
|
|

课堂评价
3. (双选)(2013·广东六校联考)燃料电池是利用燃料(如H2、CO、CH4等)跟氧气反应从而将化学能转化成电能的装置。下列关于甲烷燃料电池(NaOH溶液作电解质)的说法正确的是( )
A. 负极反应为O2+2H2O+4e- 4OH-
4OH-
B. 负极反应为CH4+10OH--8e- C
C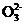 +7H2O
+7H2O
C. 放电时溶液中的阴离子向负极移动
D. 随着放电的进行,溶液的pH不发生改变
2. (2013·广东各地模拟重组)
(1)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池,则充入CH3OH 的电极为 极,充入O2的电极反应式为 。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) 2CO2(g)
+ 4H2O(g) ΔH1
2CO2(g)
+ 4H2O(g) ΔH1
②2CO(g)+ O2(g) 2CO2(g) ΔH2
2CO2(g) ΔH2
则1mol甲醇不完全燃烧生成一氧化碳和气态水时反应的ΔH= (用含ΔH1、ΔH2 的式子表示)。
(3)已知:CH3OCOOCH3(g) + C2H5OH(g) CH3OCOOC2H5(g)
+ CH3OH(g) ΔH2
CH3OCOOC2H5(g)
+ CH3OH(g) ΔH2
CH3OCOOC2H5(g) + C2H5OH(g) C2H5OCOOC2H5(g)
+ CH3OH(g) ΔH3
C2H5OCOOC2H5(g)
+ CH3OH(g) ΔH3
则CH3OCOOCH5(g)+C2H5OCOOC2H5(g) 2CH3OCOOC2H5的ΔH1= (用ΔH2和ΔH3表示)。
2CH3OCOOC2H5的ΔH1= (用ΔH2和ΔH3表示)。
题组二 电化学
1. (2013·广州调研改编)氨是最重要的化工产品之一。合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。

①
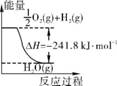
②

③
反应①、②、③为 (填“吸热”或“放热”)反应。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com