
9.(18分)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
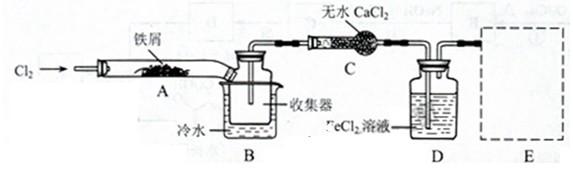
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端要使沉积的FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)装置B中冷水浴的作用为 ;装置C的名称为 ;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:
。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为 。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;② 。
8.(18分)已知2RCH2CHO R-CH2CH=C-CHO
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
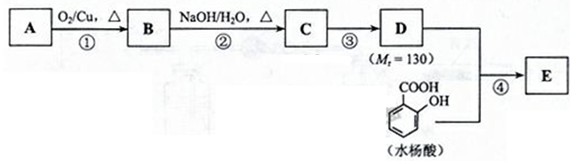
请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%,则A的分子式为 ;结构分析显示A只有一个甲基,A的名称为 。
(2)B能与新制的Cu(OH)2发生反应,该反应的化学方程式为 。
(3)C有 种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂:
。
(4)第③步的反应类型为 ;D所含官能团的名称为 。
(5)写出同时符合下列条件的水杨酸所有同分异构体的结构简式: 。
a.分子中有6个碳原子在一条直线上;
b.分子中所含官能团包括水杨酸具有的官能团。
(6)第④步的反应条件为 ;写出E的结构简式: 。
7.(14分)X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0:Q与X同主族:Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)X与Y能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
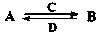 (在水溶液中进行)
(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol·L-1的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
6.为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:pb(s)+pbO2(s)+2H2SO4(aq)=2pbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是

5.下列有关电解质溶液的说法正确的是
A.在蒸馏水中滴加浓H2SO4,KW不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S 稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl 溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
4.下列实验误差分析错误的是
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
3.下列有关元素的性质及其递变规律正确的是
A.IA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
2.以下食品化学知识的叙述不正确的是
A.食盐可作调味剂,也可作食品防腐剂
B.新鲜蔬菜做熟后,所含维生素C会有损失
C.纤维素在人体内可水解为葡萄糖,故可作人类的营养物质
D.葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒
12.(20分)超导现象是20世纪人类重大发现之一,日前我国己研制出世界传输电流最
大的高温超导电缆并成功示范运行。
(l)超导体在温度特别低时电阻可以降到几乎为零,这种性质可以通过实验研究.将一个闭合超导金属圈环水平放置在匀强磁场中,磁感线垂直于圈环平面向上,逐渐降低温度使环发生由正常态到超导态的转变后突然撤去磁场,若此后环中的电流不随时间变化.则表明其电阻为零。请指出自上往下看环中电流方向,并说明理由。
(2)为探究该圆环在超导状态的电阻率上限ρ,研究人员测得撤去磁场后环中电流为I,并经一年以上的时间t未检测出电流变化。实际上仪器只能检测出大于ΔI的电流变化,其中△I<<I,当电流的变化小于△I时,仪器检测不出电流的变化,研究人员便认为电流没有变化。设环的横截面积为S,环中定向移动电子的平均速率为v,电子质量为m、电荷量为e.试用上述给出的各物理量,推导出ρ的表达式。
(3)若仍使用上述测量仪器,实验持续时间依旧为t.为使实验获得的该圆环在超导状态
的电阻率上限ρ的准确程度更高,请提出你的建议,并简要说明实现方法.
 2013年普通高等学校招生全国统一考试(天津卷)
2013年普通高等学校招生全国统一考试(天津卷)
化 学
答卷前,考生务必将自己的姓名、准考号填写在答题卡上,并在规定位置粘贴考试用条形码。答卷时,考生务必将答案涂写在答题卡上,答在试卷上的无效,考试结束后,将本试卷和答题卡一并交回。
第Ⅰ卷
A.1molH2燃烧放出的热量为H2的燃烧热
B.Na2SO3与H2O2的反应为氧化还原反应
C. 互为同系物
互为同系物
D.BaSO4的水溶液不易导电,故BaSO4是弱电解质
11.(18分)一圆筒的横截面如图所示,其圆心为O。筒内有垂直于纸面向里的匀强磁场,磁感应强度为B。圆筒下面有相距为d的平行金属板M、N,其中M板带正电荷.N板带等量负电荷。质量为m、电荷量为q的带正电粒子自M板边缘的P处由静止释放,经N板的小孔S以速度v沿半径SO方向射入磁场中.粒子与圈筒发生两次碰撞后仍从S孔射出,设粒子与圆筒碰撞过程中没有动能损失,且电荷量保持不变,在不计重力的情况下,求: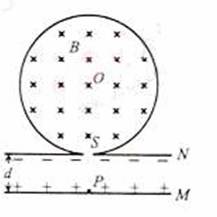
(1)M、N间电场强度E的大小;
(2)圆筒的半径R:
(3)保持M、N间电场强度E不变,仅将M板向上平移2/3d,粒子仍从M板边缘的P处由静止释放粒子自进入圆筒至从S孔射出期间,与圆筒的碰撞次数n。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com