
26.(13分)有一固体粉末,由炸药和引爆剂组成,其化学成分为中学常见的甲、乙两种化合物和三种单质。为分析其组成,进行了如下实验:
①取29.14 g固体,在一密闭容器中引爆,发生猛烈爆炸,生成的气体折合成标准状况下的体积为8.96 L,经分析,其中N2与CO2的体积比为1∶3。
②将①反应后的固体加足量的水溶解并过滤。滤液中只有一种正盐丙,通入足量氯气,可得3.21 g淡黄色沉淀,焰色反应透过蓝色钴玻璃观察火焰呈紫色。
③操作②过滤出不溶物2.14 g,元素分析表明,其中含有三种元素,均是有甲参加的某一著名反应的生成物。将此不溶物加入足量的NaOH溶液中,还剩1.12 g固体,该固体是一种可被磁铁吸引的单质丁,丁在潮湿的空气中易被氧化。
请回答下列问题:
(1)乙的化学式为__________,丙的电子式为________。
(2)写出此炸药爆炸反应的化学方程式为_____________________________________。
(3)引爆剂发生反应的化学方程式为___________________________________________,
引爆剂的作用是__________。
(4)以下物质中,有可能作为甲的替代品的是________。
A.KCl B.K2CO3 C.Na2S D.CuO
13.有M、N两溶液,各含有下列十四种离子中的七种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、SO32-、MnO4-、Fe3+、NH4+、H+、SO42-、CO32-、AlO2-。已知两溶液所含离子各不相同,每组溶液中的阳离子至少有2种,则下列说法正确的是
A.如果M溶液呈强酸性,则N溶液中可能含有的阴离子有:OH-、NO3-、CO32-
B.如果M溶液呈强碱性,则N溶液中可能含有的阴离子有:MnO4-、AlO2-、SO42-
C.如果M溶液具有强还原性,则N溶液中可能含有的阴离子有:MnO4-、NO3-、SO42-
D.如果M溶液具有强氧化性,则N溶液中可能含有的阳离子有:K+、Na+、 NH4+
12.下列说法正确的是
A.常温下,某酸H2A的钠盐NaHA溶液中:c(H2A)>c(A2-),则该溶液的pH>7
B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:
2 c(Na+)=c(CH3COO-)
C.饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,所得溶液的pH会增大
D.0.2 mol·L-1 NH4NO3和0.l mol·L-1 NaOH溶液等体积混合后:
c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+)
11.一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电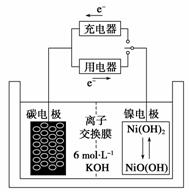 解质为6 mol·L-1KOH溶液,下列说法中正确的是
解质为6 mol·L-1KOH溶液,下列说法中正确的是
A.放电时K+移向负极
B.放电时电池负极的电极反应为H2-2e-===2H+
C.放电时电池正极的电极反应为
NiO(OH)+H2O+e-===Ni(OH)2+OH-
D.该电池充电时将碳电极与电源的正极相连
10.下列有关说法正确的是
A.由—CH3、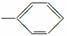 、—OH、—COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种
、—OH、—COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种
B.向含有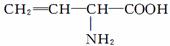 溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使其浓度下降
溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使其浓度下降
C.有机物X、Y、M的转化关系为淀粉→X→Y乙酸乙酯,X可用新制的氢氧化铜检验,现象为蓝色沉淀变成绛蓝色沉淀,加热后生成砖红色沉淀
D.高分子化合物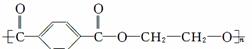 ,其链节为对苯二甲酸和乙二醇
,其链节为对苯二甲酸和乙二醇
9.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是
A.XH4的沸点比YH3的高
B.X与W形成的化合物和Z与W形成的化合物的化学键类型相同
C.Y离子的半径比Z离子的半径小
D.元素W的最高价氧化物对应水化物的酸性比Y的强
8.下列叙述正确的是
 A.将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色
A.将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色
B.将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色
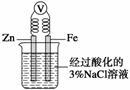
C.如右图,一段时间后给烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,可看到Fe电极附近有蓝色沉淀生成
D.向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解
7.下列说法正确的是
A.拉瓦锡发现质量守恒定律、卢瑟福发现电子、波尔提出氢原子模型都对化学学科的发展作出了重要贡献
B.实验室制备少量氢氧化铝可用下列方法:往AlCl3溶液中加入稍过量的氨水,抽滤,得到胶状沉淀经洗涤、晾干
C.核磁共振、红外光谱、紫外光谱和质谱仪,均可用于分析有机物的结构
D.维生素、PLA、油脂、甲壳素、硝化纤维都是高分子化合物
21.氘核和氚核发生聚变,放出一个中子和17.6MeV的能量.计算3克氘和3克氚聚变放出的能量,并写出核反应方程.
解:核反应方程: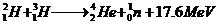
释放的能量:△E=NE0=6.02×1023×17.6MeV=1.06×1025MeV
20.静止的镭226(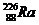 )发生α衰变,生成氡222(
)发生α衰变,生成氡222(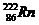 ),如果衰变中放出的能量都转化为α粒子和氡核的动能.
),如果衰变中放出的能量都转化为α粒子和氡核的动能.
(1)写出衰变方程;
(2)求α粒子与氡核的动能之比;
(3)若α粒子与氡核的运动方向与匀强磁场的方向垂直,画出轨迹示意图,并计算轨道半径之比.
解:(1)衰变方程为: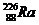 →
→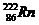 +
+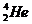
(2)衰变时动量守恒: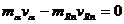 得:
得: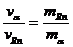
因为: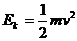 ,
所以:
,
所以: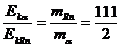
(3)因为它们在匀强磁场中的运动方向与磁场方向垂直,所以轨道半径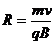
但衰变时射出的α粒子与反冲核(Rn)都带正电荷,且动量大小相等,则它们在匀强磁场做圆周运动的轨迹是一对外切圆,轨道半径和粒子电量成反比:

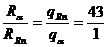
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com