
6、由一价离子组成的四种盐(AC、BD、AD、BC)溶液的浓度为1mol·L-1的溶液,在室温下前两种溶液的pH=7,第三种溶液pH>7,最后一种溶液pH<7,则( )
|
|
A |
B |
C |
D |
|
碱性 |
AOH>BOH |
AOH<BOH |
AOH>BOH |
AOH<BOH |
|
酸性 |
HC>HD |
HC>HD |
HC<HD |
HC<HD |
答案:A
解析:由AD溶液的pH>7,可知AOH的电离程度大于HD,由BC溶液的pH<7,可知BOH的电离程度小于HC。同理由AC、BD溶液的pH=7,可知AOH与HC、BOH与HD的电离程度相同。故有电离程度HC=AOH>HD=BOH,即HC的酸性大于HD,AOH的碱性大于BOH。
5、室温下向10 mL pH=3的醋酸溶液中 加入水稀释后,下列说法正确的是
加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中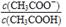 不变
不变
C. 醋酸的电离程度增大,c(H+)亦增 D. 再加入10 mL pH=11的NaOH溶液,混合液pH=7
答案:B
解析:醋酸属于弱酸,加水稀释有利于醋酸的电离,所以醋酸的电离程度增大,同时溶液中导电粒子的数目会增大,由于溶液体积变化更大,所以溶液的酸性会降低,即c(H+)、c(CH3COO-)、c(CH3COOH)均会降低,因此选项A、C均不正确;由水的离子积常数Kw=c(H+)·c(OH-) 知 c(OH-)=,所以==其中Ka表示醋酸的电离平衡常数,由于水的离子积常数和醋酸的电离平衡常数均只与温度有关,所以选项B正确;pH=3的醋酸说明醋酸的浓度大于0.001mol/L,pH=11的NaOH溶液说明氢氧化钠的浓度等于0.001mol/L,因为在 稀释过程中醋酸的物质的量是不变的,因此加入等体积的pH=11的NaOH溶液时,醋酸会过量,因此溶液显酸性,D不正确。
稀释过程中醋酸的物质的量是不变的,因此加入等体积的pH=11的NaOH溶液时,醋酸会过量,因此溶液显酸性,D不正确。
4、将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积变大、pH变小、呈中性
答案:D
解析: H2O的电离为吸热反应,将纯水加热至较高温度,电离平衡正向移动,c(H+)、c(OH-)增大,则水的离子积Kw=c(H+)·c(OH-)增大,pH=-lg c(H+)减小,而c(H+)=c(OH-),仍呈中性.
3、下列说法正确的是( )
A.根据溶 液中有CH3COOH、CH3COO-和H+即可证明CH3COOH达到电离平衡状态
液中有CH3COOH、CH3COO-和H+即可证明CH3COOH达到电离平衡状态
B.根据溶液中CH3COO-和H+的物质的量浓度相等可证明CH3COOH达到电离平衡状态
C.当NH3·H2O达到电离平衡时,溶液中NH3·H2O、NH4+和OH-的浓度相等
D.H2CO3是分步电离的,电离程度依次减弱
也相等,B错误;NH3·H2O达到电离平衡时,溶液中各粒子的浓度不变,而不是相等,何况NH3·H2O电离程度是很小的,绝大多数以NH3·H2O的 形式存
形式存 在,C错误;H2CO3是二元弱酸,分步电离且电离程度依次减小,D正确。
在,C错误;H2CO3是二元弱酸,分步电离且电离程度依次减小,D正确。
答案:D
解析:该题考查了电离平衡的判断及其特点。溶液中除电解质电离出的离子外,还存在电解质分子,能证明该电解质是弱电解质,但不能说明达到平衡状态,A错误;根据CH3COOH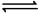 CH3COO-+H+知即使CH3COOH未达平衡状态,CH3COO- 和H+的浓度
CH3COO-+H+知即使CH3COOH未达平衡状态,CH3COO- 和H+的浓度
2、下列关于强、弱电解质的叙述中正 确的是( )
确的是( )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
D.强电解质的导电能力强,弱电解质的导电能力弱
答案:C
解析:本题需要在深刻理解强、弱电解质的异同的基础上,弄清强、弱电解质与结构的关系,采用“枚举法”来求答。选项A中,可举出HCl、HNO3是强电解质来加以否定。选项B中,可举出BaSO4、CaCO3为强电解质(尽管它们难溶于水,但它们溶于水的部分是完全电离的)来加以否定。选项D中若强电解质溶液的浓度很小时,其导电能力也会很弱,从而否定之。仅有选项C的说法是正确的,因强电解质在水中完全电离为离子,不存在溶质分子,而弱电解质在溶液中只能部分电离,溶液中还存在溶质分子。
一、选择题
1、下列说法中正确的是( )
A.由强极性键形成的化合物不 一定是强电解质
一定是强电解质
B.强电解质溶液的导电能力一定比弱电解质溶液的强
C.NaCl溶液在通电的条件下电离成钠离子和氯离子
D.NaCl晶体不导电是由于NaCl晶体中不存在离子
答案:A
解析:判断电解质强弱的依据是看其在水溶液中能否完全电离,而不是依据其中存在的化学键类型,如HF中存在强极性键,但它却是弱电解质,故选项A正确。导电能力的大小与溶液中自由移动离子浓度的大小有关,而与电解质的强弱没有必然的关系。当然在浓度相等的情况下,强电解质溶液的导电能力比弱电解质溶液的导电能力强,故选项B错误。电解质电离的条件是电解质溶于水或受热熔化,而不是通电,故选项C错误。氯化钠晶体中存在Na+和Cl-,但不能自由移动,所以固体NaCl不导电,选项D错误。
8.[解析]c是 U形管,d是烧杯。煤的干馏产物主要有:焦炭(固体)、煤焦油、粗氨水(液体)、焦炉气(H2、CH4、C2H4、CO)等,利用d将蒸气冷却,无机物中溶有氨,可利用酚酞检验;有机物可利用蒸馏使其重要成分分离出来。e处所得气体是焦炉气,点燃时火焰呈淡蓝色。
U形管,d是烧杯。煤的干馏产物主要有:焦炭(固体)、煤焦油、粗氨水(液体)、焦炉气(H2、CH4、C2H4、CO)等,利用d将蒸气冷却,无机物中溶有氨,可利用酚酞检验;有机物可利用蒸馏使其重要成分分离出来。e处所得气体是焦炉气,点燃时火焰呈淡蓝色。
答案:(1)U形管 烧杯
(2)盛装冷水对蒸气进行冷却 粗氨水 煤焦油
氨 酚酞溶液 蒸馏
(3)H2、CH4、C2H4、CO 淡蓝色
关闭Word文档返回原板块
7.[解析](1)根据题干描述:绿色化学是“预防污染”的根本手段,因此应从“源头”上杜绝。
(2)化工基地的筹建首先不宜建在人口稠密的居民区,同时要考虑水资源和交通问题。
(3)第③步由于汞的沸点低、易挥发、有毒,因此会造成环境污染。
答案:(1)D (2)B、D (3)第③步 增加冷凝回收装置
6.[解析]选D。A中反应为Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O;B中反应为3Cu+8HNO3(稀 )====3Cu(NO3)2+2NO↑+4H2O。两个反应都既浪费原料(HNO3),又污染大气(有NO2和NO气体放出)。C中,Cu在Cl2中燃烧会造成大气污染,用AgNO3作反应物不经济。D中反应为2Cu+O2
)====3Cu(NO3)2+2NO↑+4H2O。两个反应都既浪费原料(HNO3),又污染大气(有NO2和NO气体放出)。C中,Cu在Cl2中燃烧会造成大气污染,用AgNO3作反应物不经济。D中反应为2Cu+O2 2CuO,CuO+2HNO3====Cu(NO3)2+H2O,符合题目要求。
2CuO,CuO+2HNO3====Cu(NO3)2+H2O,符合题目要求。
[技法小结]物质制备实验遵循的原则
(1)条件合适,操作方便;
(2)原理正确,步骤简单;
(3)原料丰富,价格低廉;
(4)产物纯净,污染物少。
5.[解析]选C。高分子化合物可由小分子通过加成聚合反应制备,高分子化合物是混合物,虽然相对分子质量很大,但没有确 定的相对分子质量,只有一个范围,它们的结构均是由若干个链节组成的。丙烯中含碳碳双键,能发生加聚反应,故选C。
定的相对分子质量,只有一个范围,它们的结构均是由若干个链节组成的。丙烯中含碳碳双键,能发生加聚反应,故选C。
[易错提醒]该题易对C项误判,认为n是一个固定值,因而它的相对分子质量是确定的,熔、沸点是固定的,高分子 材料是
材料是 很多高分子化合物所组成的混合物,所以其相对分子质量是不确定的,熔、沸点也不固定。
很多高分子化合物所组成的混合物,所以其相对分子质量是不确定的,熔、沸点也不固定。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com