
1.“10电子”的微粒:
|
|
分子 |
离子 |
|
一核10电子的 |
Ne |
N3−、O2−、F−、Na+、Mg2+、Al3+ |
|
二核10电子的 |
HF |
OH−、 |
|
三核10电子的 |
H2O |
NH2− |
|
四核10电子的 |
NH3 |
H3O+ |
|
五核10电子的 |
CH4 |
NH4+ |
2.结构特点:
核外电子层数 元素种类
 第一周期
1
2种元素
第一周期
1
2种元素
 短周期 第二周期
2
8种元素
短周期 第二周期
2
8种元素
 周期
第三周期
3
8种元素
周期
第三周期
3
8种元素
 元 (7个横行)
第四周期
4
18种元素
元 (7个横行)
第四周期
4
18种元素
素 (7个周期) 第五周期 5 18种元素
周 长周期 第六周期 6 32种元素
期 第七周期 7 未填满(已有26种元素)
 表
主族:ⅠA~ⅦA共7个主族
表
主族:ⅠA~ⅦA共7个主族
族 副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族
(18个纵行) 第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间
(16个族) 零族:稀有气体
补充:10电子”、“18电子”的微粒小结
二、元素周期表
1.编排原则:
①按原子序数递增的顺序从左到右排列
②将电子层数相同的各元素从左到右排成一横行。(周期序数=原子的电子层数)
③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行。
主族序数=原子最外层电子数
3.元素、核素、同位素
元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。(对于原子来说)
一、原子结构
 质子(Z个)
质子(Z个)
 原子核
注意:
原子核
注意:
中子(N个) 质量数(A)=质子数(Z)+中子数(N)
|
核外电子(Z个)
★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低) 二 三 四 五 六 七
对应表示符号: K L M N O P Q
31.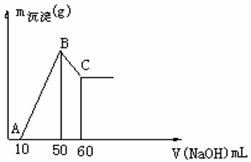 (6分)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入
(6分)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入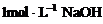 溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
求:(1)合金中镁、铝各自的质量。
(2)盐酸的物质的量浓度。
安徽省六安三中2011-2012学年第二学期高一期末模块考试化学(必修2)试题
30.(6分)实验室里常用氯化铵和足量熟石灰混合加热制取氨气。
(1)若需要500 ml (标准状况)氨气,至少需称取氯化铵的质量是多少 ?(用托盘天平称量)
(2)若将5000 ml (标准状况)氨气溶于水配成100 ml 溶液,则氨水中NH3 的物质的量浓度是多少 ?( 不考虑NH3 与水的反应)
29.(10分)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中D瓶中放有干燥红色布条;E中为铜网,E右端出气管口附近为石棉球。
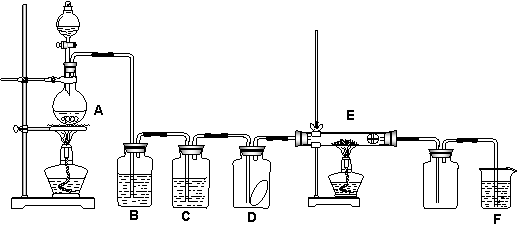
试回答:
(1)A中发生反应的方程式为_____________ _________________________________;
(2)为得到干燥纯净的氯气,一般在B瓶中加入饱和食盐水,其作用是______________;
(3)C中盛放的试剂为_____________;
(4)E中所发生反应的方程式为____________________________________________。
(5) F中应加入的试剂为 ,其作用是 。
(6) 若A中有14.6g HCl 被氧化,将产生的氯气通入足量的KI溶液中能产生单质碘的质量 为_____________g。
28.(8分) 在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下列框图进行反应。又知E溶液是无色溶液。请回答:
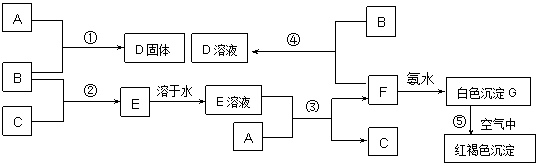
(1) (用化学式填空)
A是______________B是________________
(2)反应①的化学方程式为____________________________________________________
反应③的离子方程式为___________________________________________________
反应⑤的化学方程式为___________________________________________________
27.(12分)根据要求回答相关问题:
(1) 除去下列物质中所混有的少量杂质(括号内为杂质),写出有关的反应方程式。
①铜粉 (铝粉) ;
②FeCl3 溶液(FeCl2 ) ;
③N2 (O2) ____________________________________________________。
(2)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
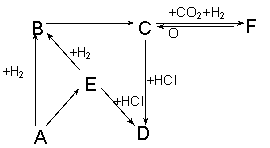
①写出A→B的化学方程式,标出电子转移的方向和数目;
____________________________________________________________
②在B→C的变化中所得C的溶液往往不纯,其中的杂质(不包括水)可能是 ,主要原因是 ;还可能是 ,主要原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com