
18.下列说法正确的是 ( )
A.pH=2和pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液c(Na+)与c(CO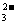 )之比为2:1
)之比为2:1
C.0.2 molL-1与0.1 molL-1醋酸中c(H+)之比为2:1
D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1
17.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3)都减少,其方法是
A 通入二氧化碳气体 B 加入氢氧化钠固体
C 通入氯化氢气体 D 加入饱和石灰水溶液
16.氢氧化铁胶体稳定存在的主要原因是
A.胶粒直径小于1nm B.胶粒作布朗运动
C.胶粒带正电荷 D.胶粒不能通过半透膜
15.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3)>c(OH)
B HN3与NH3作用生成的叠氮酸铵是共价化合物
C NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3)>c(OH)>c(H+)
D N3与CO2含相等电子数
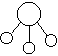
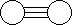
14.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10,如下图,则下列判断错误的是
 +
+ 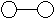
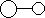 +
+ 
E G L M
A G是最活泼的非金属单质 B L是极性分子
C E能使紫色石蕊试液变蓝色 D M化学性质活泼
13.下列各组物质的溶液,不用其他试剂,仅利用溶液间的相互反应,就可以将它们区别开的是
A.KNO3 Na2SO4 CaCl2 BaCl2
B.Na2SO4 Al2(SO4)3 NaNO3 NaOH
C.NaNO3 K2CO3 NH4Cl H2SO4
D.NaHSO4 MgSO4 Na2CO3 NaOH
12.一定条件下,在密闭容器中,能表示反应X(气)+2Y(气)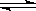 2Z(气) 一定达到化学平衡状态的是
2Z(气) 一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1︰2︰2 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A ①② B ①④ C ②③ D ③④
11.对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A 加适量的醋酸钠晶体后,两溶液的pH均增大
B 使温度都升高20℃后,两溶液的pH均不变
C 加水稀释2倍后,两溶液的pH均减小
D 加足量的锌充分反应后,两溶液中产生的氢气一样多
10.下列反应的离子方程式书写正确的是
A.硫酸铝溶液中加入过量氨水: Al3++3OH-== Al(OH)3↓
B.氢氧化钡溶液与稀硫酸反应: Ba2++OH-+H++SO42-== BaSO4 ↓+ H2O
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2== Fe3++2H2O
D.碳酸钙与盐酸反应: CaCO3+2H+== Ca2++CO2↑ +H2O
9. 单质Ti的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属Ti。由TiO2制金属Ti的反应为:
① TiO2+2C+2Cl2 ===== TiCl4+2CO ② TiCl4+2Mg ===== 2MgCl2+Ti
则下列叙述正确的是
A.由反应①可知,Cl2是氧化剂,TiCl4是氧化产物
B.由反应①可知,可用CO在高温下把TiO2还原成Ti
C.由反应②可知,若有24 g Mg参加反应,就可生成1 mol Ti
D.由反应②可知,金属Mg的还原性比金属Ti的还原性强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com