
7.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,且有良好的超导性,下列K3C60的组成和结构的分析正确的是 ( )
A.K3C60中既有离子键 ,又有极性键
B.1molK3C60中含有的离子数目为63×6.02×1023
C.该晶体熔融状态下能导电
D.该物质的化学式可定为KC20
6.根据相关化学原理,下列判断正确的是 ( )
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y
B.若KXO3+Y2===2KYO3+X2,则氧化性:Y2> X2
C.若R2- 和M+的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
5.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是 ( )
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的积不变
⑤c(H+)一定增大
A ① B ①③ C ①②④ D ①⑤
4.下列说法正确的是 ( )
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在1mol石墨晶体中,C原子数与化学键数之比为1:2
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子型化合物
3.下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是 ( )
A.Na+ 、H+ 、Cl- 、NO3- B.K+ 、Ba+ 、OH- 、I-
C.Na+、 Mg2+ 、Cl- 、SO42- D.Cu2+ 、 S2- 、Br- 、ClO-
2.设NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.1 mol NaHSO4晶体中离子总数为3NA
B.7.1g Cl2与足量NaOH(aq)反应时转移的电子总数为0.2 NA
C.1 L1 mol·L-1的Na2CO3(aq)中CO32-与HCO3-的离子数之和为NA
D.3.2gS在足量的氧气中完全燃烧所转移的电子总数为0.4NA
1.2008年夏季奥运会将在北京举行,届时要突出“绿色奥运、人文奥运、科技奥运”理念。绿色奥运是指 ( )
A.加大反恐力度,并讲求各国运动员的营养搭配,使他们全身心投入比赛。
B.严禁使用兴奋剂,使运动员公平竞争。
C.把环境保护作为奥运设施规划和建设的首要条件
D.奥运场馆建设均使用天然材料,不使用合成材料
26.(10分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
⑵ 试通过计算确定该结晶水合物的化学式。
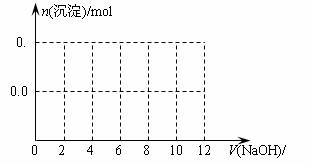
⑶假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
25.(8分)实验室定量分析某样品中亚硫酸钠的一种方法是:
①在1.520g样品中加入碳酸氢钾溶液、0.13% I2的氯仿溶液,在分液漏斗中振荡15min。离子方程式为:SO32-+I2+2HCO3-=SO42-+2I-+2CO2↑+H2O
②取①中所得的水溶液,加入一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250mL溶液。
③在②所得溶液中取25mL,滴加甲酸,除去其中过量的Br2。
方程式为:Br2+HCOOH=2HBr+CO2↑
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液。
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.1120mol/L Na2S2O3 15.10mL。离子方程式为:I2+2S2O32-=2I-+S4O62-
回答下列问题:
⑴写出②、④两步操作中所发生反应的离子方程式。
⑵①中为什么要用0.13% I2的氯仿溶液,而不直接用I2的水溶液?
⑶计算样品中亚硫酸钠的质量百分含量。
24.(10分)据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知:
①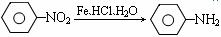 (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)
②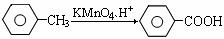
下面是PAS-Na的一种合成路线(部分反应的条件未注明):
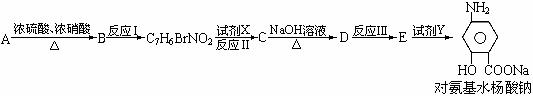
按要求回答问题:
⑴写出下列反应的化学方程式并配平
A→B:__________________________________________________________________;
B→C7H6BrNO2:__________________________________________________________;
⑵写出下列物质的结构简式:C:____________________D:______________________;
⑶指出反应类型:I_________________,II_________________;
⑷指出所加试剂名称:X______________________,Y____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com