
m(Fe)=
[解析]:由题意得知,铁的氧化物中的氧原子最后转移到沉淀物CaCO3中。且n(O)=n(CaCO3)=0.0075mol,
m(O)=0.0075mol×
2、有
A FeO B Fe2O
每次所取混合物中铜的质量6.4 g+8 g=14.4 g。
2(x+y)=3×0.1 ⑵ 解得y=0.1 mol,质量是
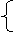 56 x+64 y=9.2 ⑴
56 x+64 y=9.2 ⑴
⑶由以上分析可知,第二次实验后剩余铜
由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体(转移0.15 mol电子)。若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g。由此可知这
9.2 g中应有Fe和Cu两种金属。
所以第一次实验后剩余金属为Fe和Cu。第二次实验后剩余金属只有Cu。
由第一组数据可知固体有剩余。无论硝酸和什么金属反应,都有n(HNO3)=4 n(NO)。加入100 mL硝酸溶液时,n(NO)=0.1mol,则n(HNO3)=0.4mol,c(HNO3)=4mol/L。
⑵Fe、Cu Cu
⑴该实验中所用硝酸的物质的量浓度为________________。
⑵第1次实验后剩余固体为_________,第2次实验后剩余固体为______。(均填写化学式)。
⑶求实验中每次所取混合物中铜的质量。
[解析]:⑴c(HNO3)=4mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com