
19. (12分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(12分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
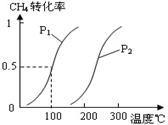
CH4(g)+H2O(g)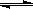 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,
将a
mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)
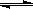 CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H 0,△S 0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
 ⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
|
ⅰ |
150 |
1/3 |
0.1 |
|
ⅱ |
|
|
5 |
|
ⅲ |
350 |
|
5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
18.(11分)阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。
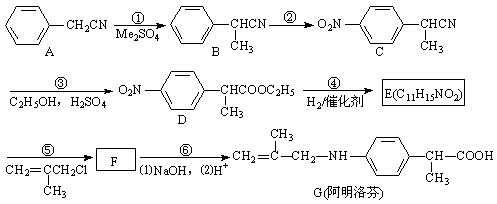
⑴反应①为取代反应,该步反应物Me2SO4中的“Me”表示 。
⑵E中的官能团有: (写名称)。 ⑶写出F的结构简式 。
⑷反应③可以看成是两步反应的总反应,第一步是氰基(-CN)的完全水解反应生成羧基(-COOH), 请写出第二步反应的化学方程式 。
⑸化合物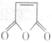 是合成某些药物的中间体。试设计合理方案由化合物
是合成某些药物的中间体。试设计合理方案由化合物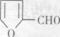 合成
合成 。提示:①合成过程中无机试剂任选;②
。提示:①合成过程中无机试剂任选;②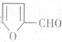 在400摄氏度金属氧化物条件下能发生脱羰基反应;③合成反应流程图表示方法示例如下:
在400摄氏度金属氧化物条件下能发生脱羰基反应;③合成反应流程图表示方法示例如下:

17.(8分)现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。
主要反应为:2ZnS +3O2 2ZnO+2SO2 ;鼓风炉中:2C +O2
2ZnO+2SO2 ;鼓风炉中:2C +O2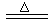 2CO
2CO
鼓风炉中:ZnO+CO Zn + CO2
Zn + CO2
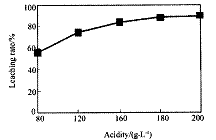
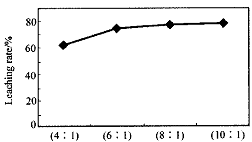
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
|
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为: 、 。
(2)湿法炼锌的主要工艺流程为

①硫酸浸取的主要反应的离子方程式为: 。
②从保护环境和充分利用原料角度,如何处理或利用烟气 。
③除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
④酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式 ___________ 、 。
16.(8分)以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KC l为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
l为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:

(1)生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
(2)下列有关说法正确的是 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑
CaS +4CO↑
C.反应Ⅳ需控制在60-70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 。
15.(10分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
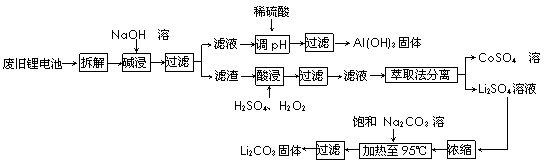
(1)上述工艺回收到的产物有 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______________。
(3)碱浸时主要反应的离子方程式为_____________________。
(4)酸浸时反应的化学方程式为___________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是_______________。
(5)生成Li2CO3的化学反应方程式为____________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应____________。
14.(6分)柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
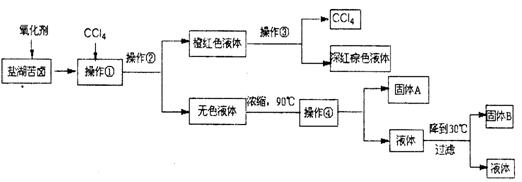
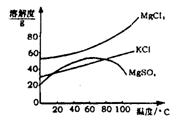 请根据以上流程,回答相关问题:
请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是
(2)参照右图溶解度曲线,得到的固体A的主要成分是
(填化学式)。
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
[有关资料]
|
化学式 |
BaCO3 |
BaSO4 |
Ca(OH)2 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
8.1×10一9 |
1.08×10一10 |
1.0×10一4 |
3.5×10一5 |
1.6×10一11 |
[设计除杂过程]
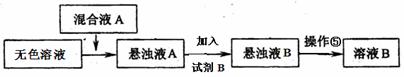
①已知试剂B是K2CO3溶液,则混合液A的主要成分是 (填化学式)。
[获取纯净氯化钾]
②对溶液B加热并不断滴加l mol· L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。
③将溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
[问题讨论]
④进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为 。
13.(11分)某学生利用以下装置探究喷泉实验。其中A、F分别为硫化氢和氯气的发生装置,C为纯净干燥的氯气与硫化氢反应的装置。
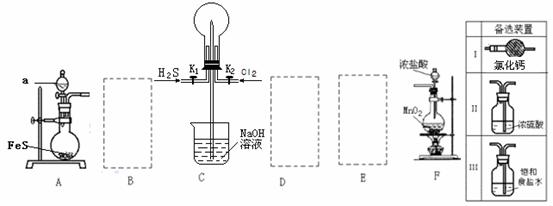
请回答下列问题:
(1)装置F中发生反应的化学方程式 。
(2)装置A中的分液漏斗内液体a宜选用 (选填以下选项的代号)
A.盐酸 B.浓硫酸 C.稀硫酸 D.稀硝酸
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择。并将编号填入下列空格。
B__________、D__________、E__________(填编号)
(4)打开K1、K2,将常温压下的H2S、Cl2以体积比1:1充满烧瓶后,再关闭K1、K2,始终看不到烧瓶内产生“喷泉”现象,理由(用简要文字并配备化学方程式描述): 。
(5)在操作(4)的基础上,引发喷泉操作方法是 。
12.根据表中提供的数据,判断下列说法正确的是
AB电离理论
A.等浓度的NaCN、NaHCO3、Na2CO3溶液中,pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a一定大于b
C.等浓度的NaCN、NaHCO3混合溶液中c(Na+)+ c(H+) =c(CN-) + c(HCO3-) + c(OH-)
D.NaCN溶液中通入少量CO2,发生的反应可表示为:2NaCN + H2O + CO2 = 2HCN + Na2CO3
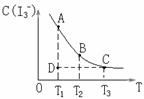
11.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq) △H =Q ,某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
I3-(aq) △H =Q ,某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
A.反应 I2(aq)+I-(aq) I3-(aq) △H =Q的 Q>0
I3-(aq) △H =Q的 Q>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K2>K1
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
|
化学式 |
电离常数(25℃) |
|
HCN |
4.9×l0-10 |
|
H2CO3 |
K1=4.3×l0-7、K2=5.6×l0-11 |
10.在下列各组溶液中,离子一定能大量共存的是
A.加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I-
B.常温下,pH=1的溶液:Fe3+、Na+、NO3-、SO42-
C.滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO42-
 D.含0.1mol/LNH4Al(SO4)2·12H2O的溶液:K+、Ca2+、NO3-、OH-
D.含0.1mol/LNH4Al(SO4)2·12H2O的溶液:K+、Ca2+、NO3-、OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com