
3.《中国通史》记载:道光二十六年,江苏松江、太仓一带出现了“……松、太布市,消减大半”。导致这种现象出现的主要原因是
A.自然经济逐步解体 B.外国棉布大量输入
C.农民需求大量减少 D.自然灾害破坏严重
2.随着汽车、火车、轮船在近代中国的出现,“乘客不分男女座,可怜坐下挤非常”。其中“乘客不分男女座”反映了
A.新式交通工具的出现冲击了传统的伦理道德
B.人们对新式交通工具的认同,方便快捷
C.新式交通工具并没有改变人们的出行状况
D.人们并没有停止对新式交通工具改进的追求
1.二十四节气是我国古代历法的重要组成部分。古人根据太阳一年内的位置变化以及所引起的地面气候的演变次序,把一年三百六十五又四分之一的天数分成二十四段,分列在十二个月中,以反映四季、气温、物候等情况,这就是二十四节气。二十四节气中的“清明”一般是在农历
A.二月 B.三月 C.四月 D.五月
2.所有答案必须做在答卷的相应位置上,做在试卷上无效。
试卷Ⅰ(选择题 共50分)
本卷共25小题,每小题2分,共50分。在每题给出的四个选项中,只有一项是最符合题目要求的。
1.全卷分试卷Ⅰ、Ⅱ,满分为l00分。
24.(6分)某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
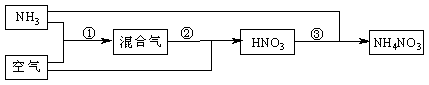
其中反应①为4NH3+5O2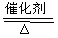 4NO+6H2O
4NO+6H2O
⑴步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示
为_ _。
⑵若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为_________ ___。
⑶假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?(要求写出解题过程)
23.(6分)氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,与0.100 mol / L HCl标准溶液反应,完全反应共消耗标准液20.0 mL(杂质不与酸反应),试样中氢氧化钡的物质的量 。
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,Ba(OH)2·nH2O中的n值为 。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
22.(10分)
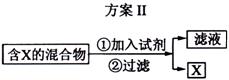
下图表示从固体混合物中分离X的2种方案,请回答有关问题。
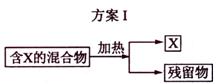
(1)选用方案I时,X应该具有的性质是 ,残留物应该具有的性质是 ;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为 ;
(3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)
21.(10分)海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
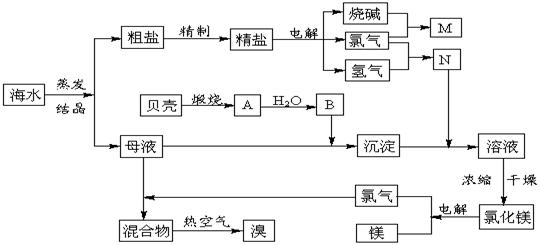
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液。
则加入试剂的顺序是(填编号) 。
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 。
www.
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式:
。
(4)此工业煅烧贝壳得到氧化钙。石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外) 。
(5)利用MgCl2· 6H2O可制得无水氯化镁,应采取的措施是 。
(6)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
。
20.(6分)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
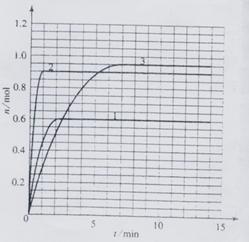 (1) 体系中发生反应的化学方程式是________________;
(1) 体系中发生反应的化学方程式是________________;
(2)列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(3)该反应达到平衡时反应物X的转化率A等于___________________________;
(4)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如右图所示)则曲线1、2、3所对应的实验条件改变分别是:
1______________ 2________________ 3__________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com