
3.(09年广东理基·22)下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
答案:C
2. (09年福建理综·7)能实现下列物质间直接转化的元素是
(09年福建理综·7)能实现下列物质间直接转化的元素是

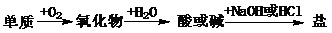
 A.硅 B.硫 C.铜 D.铁
A.硅 B.硫 C.铜 D.铁
答案:B
1.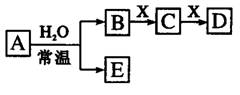 (09年北京理综·12)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
(09年北京理综·12)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3-
=H2O+CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是

D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
答案:A
54. (09年安徽理综·26)(12分)
(09年安徽理综·26)(12分)
 某厂废水中含5.00×10-3mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
某厂废水中含5.00×10-3mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
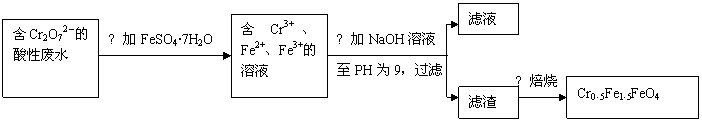






 (1)第①步反应的离子方程式是
。
(1)第①步反应的离子方程式是
。
 (2)第②步中用PH试纸测定溶液PH的操作是:
。
(2)第②步中用PH试纸测定溶液PH的操作是:
。
 (3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
。
 (4)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入
(4)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入
 g FeSO4·7H2O。
g FeSO4·7H2O。
 答案:
答案:
 (1)Cr2O72-+6Fe2++14H+
(1)Cr2O72-+6Fe2++14H+ 2Cr3+ +6Fe3++7H2O
2Cr3+ +6Fe3++7H2O
 (2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
 (3)Fe(OH)3、Fe(OH)2
(3)Fe(OH)3、Fe(OH)2
 (4)13.9
(4)13.9
53.(09年北京理综·26)(15分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeC03的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeC03固体。
ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是
。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用
。
(3)Ⅲ中,生成FeCO3的离子方程式是
。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
。
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42的操作是
。
(5)已知煅烧FeC03的化学方程式是4FeCO3+O2  2Fe2O3+4CO2。现煅烧464.0 kg 的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量
2Fe2O3+4CO2。现煅烧464.0 kg 的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量
是 Kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
答案:(15分)(1)Fe+2Fe3+=3Fe2+(2)加入硫酸,H+浓度增大,使Fe2++2H2O Fe(OH)2+2H+得平衡向逆反应方向移动,从而抑制FeSO4的水解(3)Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 4FeCO3+6H2O+O2=4Fe(OH)3↓+4CO2↑(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净(5)288.0
Fe(OH)2+2H+得平衡向逆反应方向移动,从而抑制FeSO4的水解(3)Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 4FeCO3+6H2O+O2=4Fe(OH)3↓+4CO2↑(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净(5)288.0
52.(09年广东化学·24)(11分)
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超Al2O3,NH4AlO(OH)HCO3热分解的化学反应方程式 。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mlPH为2浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2·12H2O固体 g。
②将上述固体置于烧杯中 。
(3)在0.1mol·l-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液ph变化的关系见下图
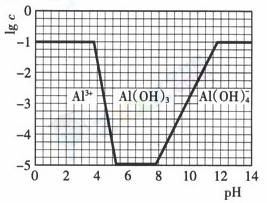
①用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有 ②请在答题卡的框图中,画出0.01mol·l-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图,并进行必要的标注。
答案:(1)2NH4AlO(OH)HCO3 2NH3↑+Al2O3+3H2O↑+2CO2↑(2)将4.5g固体置于烧杯中,边加蒸馏水溶解边用玻璃棒搅拌,待完全溶解后,用玻璃棒移液至100ml的容量瓶中,用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中,加蒸馏水至刻度线2~3cm处应改用胶头滴管,上下振荡,静置,将配置好的溶液装入试剂瓶中,并贴上标签。
2NH3↑+Al2O3+3H2O↑+2CO2↑(2)将4.5g固体置于烧杯中,边加蒸馏水溶解边用玻璃棒搅拌,待完全溶解后,用玻璃棒移液至100ml的容量瓶中,用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中,加蒸馏水至刻度线2~3cm处应改用胶头滴管,上下振荡,静置,将配置好的溶液装入试剂瓶中,并贴上标签。
(3)图略。作图要点:起始与最终数值为-2;刚开始产生沉淀时PH要增大;完全沉淀和沉淀溶解时的PH应与原图一样;氢氧化铝完全溶解时的PH也是不变的二纵座标发生改变,所以线要与原图有所区别。
51.(09年广东化学·22)(12分)
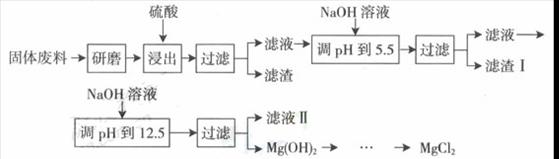
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
pH |
3.4 |
5.2 |
12.4 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)
(2)滤渣I的主要成分有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
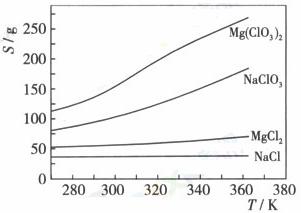
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
答案:(1)增大硫酸浓度;加热升高温度;边加硫酸边搅拌(要求写出两条)
(2)滤渣Ⅰ主要成分有Fe(OH)3、Al(OH)3
(3)从滤液Ⅱ中可回收利用的主要物质有CaSO4、Na2SO4
(4)①该反应的生成物为Mg(ClO3)2和NaCl的混合溶液,NaCl的溶解度随温度变化不大,Mg(ClO3)2的溶解度随温度升高而升高。利用两物的溶解度差异,通过加热蒸发浓缩,冷却结晶,过滤,将Mg(ClO3)2与NaCl分离,制得Mg(ClO3)2。
②因为在相同温度向下NaCl的溶解度最小,所以在冷却结晶过程中,会有少量NaCl随Mg(ClO3)2析出;重结晶。
50. (09年海南化学·13)(9分)
(09年海南化学·13)(9分)
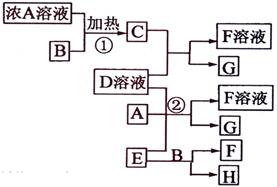
 有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。


 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
 (3)写出另外一种实验室制取H的化学方程式
(3)写出另外一种实验室制取H的化学方程式
 (4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L
,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L
,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
答案:(9分)


 (1)MnO2+4HCl(浓)
(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
 (2)6I-+ClO3-+6H+=3I2+Cl-+3H2O(2分)
(2)6I-+ClO3-+6H+=3I2+Cl-+3H2O(2分)
 (3)2H2O2
(3)2H2O2 2H2O+O2↑或2KMnO4
2H2O+O2↑或2KMnO4 K2MnO4+MnO2+O2↑(其他合理答案也给分)(2分)
K2MnO4+MnO2+O2↑(其他合理答案也给分)(2分)
 (4)5.6×10-4mol·L-1(3分)
(4)5.6×10-4mol·L-1(3分)
48.
 (09年江苏化学·16)(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(09年江苏化学·16)(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

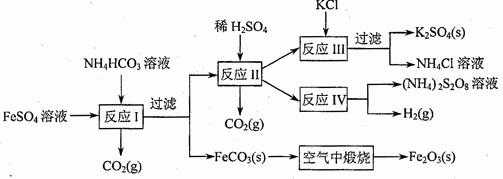
 (1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
(1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
 A.锌粉 B.铁屑 C.KI溶液 D.H2
A.锌粉 B.铁屑 C.KI溶液 D.H2
 (2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
(2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
 (4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
 答案:(1)B
答案:(1)B
 (2)防止NH4HCO3分解(或减少Fe2+的水解)
(2)防止NH4HCO3分解(或减少Fe2+的水解)
 (3)降低K2SO4
的溶解度,有利于K2SO4 析出。
(3)降低K2SO4
的溶解度,有利于K2SO4 析出。
 (4)2SO42-
-2e-
(4)2SO42-
-2e- 2S2O82-
2S2O82-
49 .(09年海南化学·11)在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:
.(09年海南化学·11)在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:

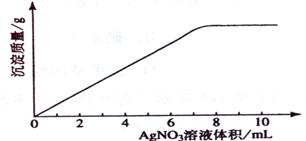
 A.+1 B.+2 C.+3 D.+4
A.+1 B.+2 C.+3 D.+4
答案:C
47. (09年江苏化学·15)(10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
(09年江苏化学·15)(10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:


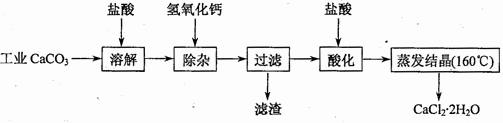
 (1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以出去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是 。
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以出去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是 。
 (2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
 (3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
 ①上述测定过程中需要溶液润洗的仪器有 。
①上述测定过程中需要溶液润洗的仪器有 。
 ②计算上述样品中CaCl2·2H2O的质量分数为 。
②计算上述样品中CaCl2·2H2O的质量分数为 。
 ③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ; 。
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ; 。
 答案:
答案:
(1)取少量上层清液,滴加KSCN溶液,,若不出现血红色,则表明Fe(OH)3 沉淀完全。
 (2)防止溶液吸收空气中CO2
(2)防止溶液吸收空气中CO2
 (3)①酸式滴定管
(3)①酸式滴定管 ②99.9%
②99.9% ③样品中存在少量的NaCl 少量的CaCl2·2H2O失水
③样品中存在少量的NaCl 少量的CaCl2·2H2O失水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com