
4.HF、H2O、NH3 的沸点有反常现象,是因为它们的分子之间存在着一种比分子间作用力稍强的相互作用,这种相互作用叫
。氢键比
弱,比
强,所以把氢键看作是一种稍强的分子间作用力。例如:H2Te、H2Se、H2S随相对分子质量的减小,分子间作用力依次减弱,因而熔沸点依次降低。然而H2O由于分子间氢键的形成,分子间作用力骤然增强,从而改变了Te-O氢化物熔沸点降低的趋势而猛然升高,卤族中的HF和氮族中的NH3也有类似情况 21世纪教育网
21世纪教育网

|
化 学 键 |
定义 |
晶体或分子内直接相邻的两个或多个原子之间的强烈相互作用,通常叫做化学键。化学键的键能通常在120KJ/mol-800KJ/mol |
|
强烈的体现形式 |
使原子间形成一个整体,彼此不能发生相对移动,只能在一定平衡位置 振动。破坏这种作用需消耗较大能量。 |
|
|
离 子 键 |
定义 |
阴、阳离子间通过静电作用所形成的化学键叫做离子键。 |
|
本质 |
阴阳离子间的静电作用 |
|
|
形成条件和原因 |
 活泼金属 M 活泼金属 M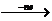 Mn+(稳定的阳离子) Mn+(稳定的阳离子)活泼非金属 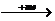 Xm-(稳定的阴离子) Xm-(稳定的阴离子)
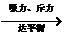 离子键 离子键 |
|
|
形成过程表示方法 |
mM+nX→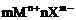 |
|
|
影响强度的因素及对物质性质的影响 |
1.离子半径:离子半径越小,作用越强。含有该键的离子化合物的熔沸点就越高。 2.离子电荷:离子电荷越多,作用越强。含有该键的离子化合物的熔沸点就越高。 |
|
|
共价键 |
定义 |
原子间通过共用电子对所形成的化学键,叫共价键 |
|
形成条件 |
一般是非金属元素之间形成共价键,成键原子具有未成对电子 |
|
|
本质 |
成键的两原子核与共用电子对的静电作用. |
|
|
表示方法 |
1.电子式: |
|
|
2.结构式 |
||
|
形成过程 |
|
|
|
分类 |
分类依据:共用电子对是否发生偏移与电子提供对象 |
|
|
非极性键 |
定义:共用电子对不偏于任何一方 特定:存在于同种原子之间 A-A单质、共价化合物、离子化合物、离子化合物中都可能含有此键。例:Cl2、H2O2、Na2O2 |
|
|
极性键 |
定义:共用电子对偏向成键原子的一方 特点:存在于不同种原子之间 B-A 共价化合物、离子化合物中都可能含有此键 |
|
|
配位键 |
是一种特殊的共价键。由成键的双方原子中,一方原子提供孤对电子,另一方原子提供空轨道而形成共用电子对,这种共价键叫配位键。如NH3和H+以配位键形成NH4+,H2O和H+以配位键形成H3O+等[Ag(NH3)2]+, |
|
|
键 参 数 |
键能 |
在气态时拆开拆开1mol共价键所吸收的能量或形成1mol共价键所放出的能量,这个键能就
叫键能。键能越大,键越牢固,分子越稳定。 |
|
键长 |
两成键原子核之间的平均距离叫键长。 键越短、键能较大,键越牢固,分子越稳定。 |
|
|
键角 |
分子中相邻的键和键之间的夹角叫键角。它决定分子的空间构型和分子的极性 |

3.分子间作用力对物质物理性质的影响
一般来说,对于 和 的物质, , ,物质的 、 也越高。例如,卤素单质,随着相对分子质量的增大,分子间作用力增大,它们的熔点,沸点也相应升高。
2.分子间作用力与化学键的区别
分子间作用力存在于:分子与分子之间。 化学键存在于:分子内相邻的原子之间。
1.分子间作用力:
注意:分子间作用力不是化学键,它比化学键要弱得多,它广泛地存在于分子与分子之间,但只有在分子与分子充分接近时,分子间才有明显的作用。分子间作用力对物质的熔点、沸点、溶解度等都有影响 21世纪教育网
21世纪教育网
2、强弱判断
① 价电子数,② 原子半径 规律:______________________
1、概念:金属晶体中,金属阳离子与_____________________之间较强的相互作用。
4. 共价键参数
键 长:
键 角:
键 能:
小 结:其中 、 是衡量共价稳定性的参数,通常键长越 ,键能越大,表明共价键越稳定;共价键具有 性, 是描述分子立体结构的重要参数,分子的立体结构还与 有一定的关系。
[例3]关于化学键的下列叙述中,正确的是( )
A.离子化合物中可能含有共价键
B.共价化合物中可能含有离子键
C.离子化合物中只含离子键
D.共价键只能存在于化合物中
解析与评价:离子键只存在于离子化合物中,共价键可存在于离子化合物、共价化合物以及某些单质中 21世纪教育网
21世纪教育网
答 案: A
[变式训练3]下列化合物中既存在离子键,又存在极性键的是 ( )
A.H2O B.NH4Cl C.NaOH D.Na2O2
[例4]下列分子中所有原子都满足最外层8电子结构的是
A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
 解析与评价:分子中的原子是否满足8电子结构,决定于中心原子的最外层电子数和形成共价键的数目
解析与评价:分子中的原子是否满足8电子结构,决定于中心原子的最外层电子数和形成共价键的数目
答案:A
[例5]对δ键的认识不正确的是 ( )
A.δ键不属于共价键,是另一种化学键
B.S-Sδ键与S-Pδ键的对称性相同
C.分子中含有共价键,则至少含有一个δ键
D.含有π键的化合物与只含δ键的化合物的化学性质不同
解析与评价:共价键包括δ键和π键,δ键不管是S-Sδ键、S-Pδ键还是P-Pδ键都是轴对称的,π键不够稳定,必须与δ键共存
答案:A
[例6]下列分子中,键能最小的是
A.F2 B.Br2 C.Cl2 D.N2
解析与评价:N2中含有一个三键,键能较大;F2、Br2、Cl2中只有一个单键,键能小,F2分子中电子“密度”大,F原子间斥力大,键能最小
答案:A
[变式训练6]能够用键能解释的是 ( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
[例7](2008山东)氮是地球上极为丰富的元素。 的键能为
942 kJ·mol-1 , N-N
单键的键能为 247kJ·mol-1,计算说明N2
中的
键比
_键稳定(填“σ ”或“π
”)
的键能为
942 kJ·mol-1 , N-N
单键的键能为 247kJ·mol-1,计算说明N2
中的
键比
_键稳定(填“σ ”或“π
”)  21世纪教育网
21世纪教育网
解析与评价:本题主要考查物质结构的原理及其应用,较难。根据题给数据可知,N-N单键即σ键的键能为247kJ/mol,N≡N的键能为942kJ/mol,其中包含一个σ键和两个π键,则π键的键能是(942-247)/2=347.5kJ/mol,键能越大,化学键越稳定,由数据可以判断π键比σ键稳定 21世纪教育网
21世纪教育网
答案:π键比σ键稳定
[变式训练7](08四川卷)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)Y的最高价氧化物的化学式为______________。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是________,写出该元素的任意3种含氧酸的化学式:_______________________。
 (3)D和形成的化合物,其分子的空间构型为________________。
(3)D和形成的化合物,其分子的空间构型为________________。
(4)D和X形成的化合物,其化学键类型属______,其晶体类型属____________。
(5)金属镁和E的单质在高温下反应得到的产物是________,此产物与水反应生成两种碱,该反应的化学方程式是___________________________。
(6)试比较D和X的最高价氧化物熔点的高低并说明理由__________________。
3. 共价键的分类
●依据键的极性分类:
①非极性键:在双原子单质分子中,同种原子形成的共价键,两原子吸引电子的能力 ,共用电子对 任何一个原子,成键的原子都 电性。这样的共价键叫做非极性共价键,简称非极性键,可见非极性键是同种原子之间形成的共价键。如:H-H键,Cl-Cl键,Na2O2 中的O-O键等。
②极性键::在化合物分子中,不同种原子形成的共价键,由于不同种原子吸引电子的能力 ,共用电子对必然偏向吸引电子能力 的一方,所以吸引电子能力强的一方显 电性,吸引电子能力弱的一方显 电性。这样的共价键叫做极性共价键,简称极性键,可见极性键是不同种原子之间形成的共价键。如:H-Cl键,NaOH中的O-H键等 21世纪教育网
21世纪教育网
● 依据成键方式分类:
①键:原子轨道沿着核间连线方向以 方式形成的共价键;
②键:原子轨道沿着核间连线两侧方向以 方式形成的共价键;
2. 共价键的表示方法
①电子式:H2 Cl2 N2 O2
CO2 CH4 HCl H2O NH3
②结构式(用短线“-”表示一对共用电子):H2 N2 HCl
H2O NH3 CO2 CH4 Cl2
③用电子式表示下列形成过程:
H2 :
HCl:
CO2 :
 H2O:
H2O:
1. 共价键 :
①成键微粒 :
②成键本质:
③成键条件:
小 结:(1)只含有共价键的化合物属于共价化合物(即若存在离子键,就为离子化合物)
(2)共价键存在于非金属单质的双原子分子中,共价化合物和某些离子化合物
中(如NaOH、Na2O2 )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com