
16.391.55kJ/mol
13.在化学反应过程中,(恒温条件下)所吸收或放出的热量;恒温;敞口容器;△H;kJ/mol;负;<;正;>;14.吸收能量;放出能量;反应物和生成物所具有的总能量的相对大小;放热;吸热;15.SiH4(g)+202(g)=SiO2(s)+2H2O(1); △H=-1427.2kJ·mol-1
16.由N2和H2合成1molNH3时可放出46.2 kJ·molˉl的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0 kJ·molˉl,试计算N-H键的键能是 ?
1C;2C;3B;4C;5C;6C;7C;8A;9D;10C;11A;12B;
15.甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,常温下1g甲硅烷自燃放出的热量为44.6KJ,其热化学方程式为 。
14.从能量的角度看,断开化学键要 ,形成化学键要 。化学反应是释放能量还是吸收能量取决于 ____________,当反应物的总能量高于生成物时,该反应为 __反应;当反应物的总能量低于生成物时,该反应为 __反应。
13. 叫反应热;在中学化学中,一般研究的是在 下,在 中发生的反应所放出或吸收的热量。反应热用符号 表示,单位一般采用 。对放热反应,△H为 数,即△H 0;对吸热反应,△H为 数,即△H 0 。
12.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g) + O2(g) = 2CO2(g); △H =-566 kJ·molˉl
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l); △H =-890 kJ·molˉl
由1molCO和3molCH4组成的混和气在上述条件下完全燃烧时,释放的热量为
A.2912kJ B.2953kJ C.3236kJ D.3867kJ
11.下列各图所表示的反应是吸热反应的是
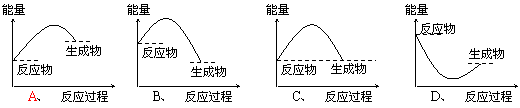
10.已知:C(石墨)=C(金刚石);△H>O,则可判断
A.金刚石比石墨稳定 B.一样稳定 C.石墨比金刚石稳定 D.无法判断
9.下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)→C(石墨);ΔH=+119 kJ·molˉl可知,石墨比金刚石稳定
C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8 kJ·molˉl
D.稀溶液中:H+(aq)+OHˉ(aq)=H2O(l);ΔH=-53.7 kJ·molˉl,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7 kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com