
5.(北京理综第10题 6分)甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第二周期IVA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
4.答案:B
解析:W是短周期元素,W的最外层电子数与核外电子总数之比为7:17,公比是2的话核外电子总数是34,不在短周期元素范围之内,公比只能是1,W是17号元素氯,X与W同主族,X是氟元素,X的原子序数是9,Y的原子序数是W和X的原子序数之和的一半, Y的原子序数是13,Y元素是铝元素;含Z元素的物质焰色反应为黄色,Z元素是钠元素。金属性:Na>Al, 即Z> Y,A错误;离子的还原性:Cl->F- ,即W >X,C错误;氢化物的沸点:HF>HCl,HF 分子间能形成氢键分子键作用力远大于HCl分子键作用力,即X>W,B正确;原子半径:Z>Y>X,离子半径:W> X >Z>Y,D错误。
>X,C错误;氢化物的沸点:HF>HCl,HF 分子间能形成氢键分子键作用力远大于HCl分子键作用力,即X>W,B正确;原子半径:Z>Y>X,离子半径:W> X >Z>Y,D错误。
要点1:钠元素的突破口:短周期元素中原子半径最大的元素、金属性最强的元素、最高价氧化物对应的水化物碱性最强的元素、焰色反应为黄色的元素。
要点2:原子半径:Na>Al>Cl>F,离子半径:Cl->F->Na+>Al3+ 。
要点3:金属的还原性:Na>Al,离子的还原性:Cl->F- 。
要点4:氢化物的沸点:HF>HCl,氢化物的热稳定性:HF>HCl,氢化物的还原性:HCl>HF,氢化物水溶液的酸性:HCl>HF。
要点5:元素最高价氧化物对应氧化物的酸碱性:酸性:HClO4>Al(OH)3 ,碱性:NaOH>Al(OH)3 。
要点6:铝元素的突破口:同周期元素中离子半径最小的元素,最高价氧化物及其水化物均呈两性的元素,同周期金属元素的氧化物熔点最高的元素,常温下遇到浓硫酸或浓硝酸钝化的元素,同周期金属元素原子半径和离子半径都是最小的元素,工业上可以用来冶炼难熔金属的强还原剂。
4.(北京理综化学第7题 6分)W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是
A.金属性:Y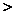 Z
B 氢化物的沸点:X>W
Z
B 氢化物的沸点:X>W
C.离子的还原性:X>W D 原子及离子半径:Z>Y>X
D 原子及离子半径:Z>Y>X
3. 答案:C
答案:C
 详解:原子半径最小的元素是氢元素;短周期元素次外层电子数只有2或8两种情况,Y原子最外层电子数是次外层电子数的3倍,Y的最外层不可能是24,只能是6,Y是氧元素;R与Y处于同一族,R是硫元素,R是第三周期元素;Z、W、R处于同一周期,Z、W也是第三周期元素, Z、W原子的核外电子数之和与Y、R原子的核外电子数之和(8+16=24)相等,Z是钠元素,W是铝元素。Y、Z、W具有相同电子层结构的离子其半径依次减小,A错误;X和Y元素能形成2种化合物:X2Y(H2O)和X2Y2(H2O2),B错误;非金属性越强氢化物越稳定,C正确;元素W、R的最高价氧化物的水化物分别是Al(OH)3 和H2SO4,只有硫酸是强酸,偏铝酸是弱酸。
详解:原子半径最小的元素是氢元素;短周期元素次外层电子数只有2或8两种情况,Y原子最外层电子数是次外层电子数的3倍,Y的最外层不可能是24,只能是6,Y是氧元素;R与Y处于同一族,R是硫元素,R是第三周期元素;Z、W、R处于同一周期,Z、W也是第三周期元素, Z、W原子的核外电子数之和与Y、R原子的核外电子数之和(8+16=24)相等,Z是钠元素,W是铝元素。Y、Z、W具有相同电子层结构的离子其半径依次减小,A错误;X和Y元素能形成2种化合物:X2Y(H2O)和X2Y2(H2O2),B错误;非金属性越强氢化物越稳定,C正确;元素W、R的最高价氧化物的水化物分别是Al(OH)3 和H2SO4,只有硫酸是强酸,偏铝酸是弱酸。
 要点1:根据半径之最推断元素:
要点1:根据半径之最推断元素:
(1)所有元素中原子半径最小的是氢元素。
(2)同周期主族元素VIIA的元素半径最小,IA的元素半径最大。
(3)同主族元素原子序数最小的元素原子半径最小,原子序数最大的元素原子半径最大。
(4)不同周期不同主族的元素左下角的元素半径最大,右上角的元素半径最小(有氢元素时氢元素最小)。
(5)电子层结构相同的离子核电荷数最小的离子半径最大,核电荷数最大的离子半径最小。
要点2:非金属元素的变价范围及其可能的氢化物种类:
(1)非金属元素的变价范围是最低价态和最高价态之间的所有价态都可能。
(2)非金属元素的最低价态是最外层电子数减8(氢、硼元素除外)。
(3)非金属元素的最高价态是最外层电子数(氧、氟例外)。
(4)碳元素的几种价态对应的化合物
|
价态 |
0 |
-1 |
-2 |
-3 |
-4 |
|
对应的化合物 |
HCHO |
HC≡CH |
CH2=CH2 |
CH3CH3 |
CH4 |
(5)氮、氧元素几种价态对应的化合物
|
价态 |
0 |
-1 |
-2 |
-2 |
-3 |
|
对应的化合物 |
H-O-F |
H-O-O-H |
H2O |
N2H4 |
NH3 |
3. (江苏化学卷第8题 3分) X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
(江苏化学卷第8题 3分) X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
 A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
 B.元素X不能与元素Y形成化合物X2Y2
B.元素X不能与元素Y形成化合物X2Y2
 C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
 D.元素W、R的最高价氧化物的水化物都是强酸
D.元素W、R的最高价氧化物的水化物都是强酸
2.答案:B
详解:X+与Z2-具有相同的核外电子层结构,离子的电子层结构相同的有氦、氖或氩性电子层结构,明显氦型电子层结构不成立,如果是氩型电子层结构,X是19K,Z是16S,元素X、Y、Z原子序数之和为36,Y是1H,X、Y同主族,题给信息X、Y同周期,氩型电子层结构也不成立;只能是氖型电子层结构,X为11Na ,Z为8O, Y为17Cl。同周期(第三周期中)X(Na)的金属性最强,A正确;同周期元素从左向右原子半径减小,原子半径X(Na)>Y(Cl),电子层结构相同的离子,离子半径随核电荷数的增加而减小,离子半径X(Na+)<Z(O2-),B错误;同族元素中(VIA族)Z(O)的氢化物稳定性最高,C正确;同周期(第三周期中)Y(Cl)的非金属性最强,则最高价含氧酸的酸性最强(HClO4),D正确。
要点1:电子层结构相同的离子组:
(1)氦型:H- 、Li+ 、Be2+
(2)氖型:N3- 、O2- 、F- 、Na+、 Mg2+ 、Al3+
(3)氩型:P3- 、S2- 、Cl- 、K+ 、Ca2+
要点2:同周期元素的金属性:原子序数越小,金属性越强,对应最高价氧化物的水化物的碱性越强。
要点3:同周期元素的非金属性:原子序数越大,非金属性越强,对应最高价氧化物的水化物的酸性越强。
要点4:同主族元素的金属性和非金属性:原子序数越大,金属性逐渐增强,非金属性逐渐减弱。
要点5:非金属性和氢化物稳定性的关系:非金属性越强,对应的氢化物越稳定;同周期非金属元素原子序数大的氢化物稳定;同主族非金属元素原子序数小的氢化物稳定,从元素周期表中的位置关系看,右上角的非金属元素氢化物稳定。
要点6:同族微粒的半径规律:原子或离子的半径随原子序数的增大而增大。
要点7:同周期的原子半径或电子层结构相同的离子半径:核电荷数越小对应的半径越大。
要点8:同周期的离子半径:阴离子半径大于阳离子半径,第三周期离子半径最小的是铝离子。
要点9:同核的不同微粒半径比较:电子数越多半径越大,H->H>H+ ,Fe>Fe2+>Fe3+ ,Cl->Cl.
2.(广东化学卷第11题 4分).元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强 B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高 D.同周期元素中Y的最高价含氧酸的酸性最强
1.答案:D
详解:IVA元素有碳、硅、锗、锡、铅;第四周期元素是锗,其化学性质类硅,硅不和水反应,锗也不和水反应,A不符合题意;二氧化硅可以被碳或氢还原为硅,二氧化锗也可以,B不符合题意;GeCl4和SiCl4都是分子晶体,分子间不能形成氢键,对于组成和结构相似的分子晶体,相对分子质量越大,沸点越高,C不符合题意;同主族元素,原子序数越小非金属性越强,非金属性越强,其最低价氢化物的稳定性越强,氢化物稳定性:SiH4>GeH4 ,D符合题意。
要点1:组成和结构相似的分子晶体(不含氢键),相对分子质量越大,沸点越高。
①.IVA最低价非金属氢化物的沸点由高到底顺序:GeH4>SiH4>CH4
②.IVA最高价氯化物的沸点由高到底顺序:GeCl4>SiCl4>CCl4
要点2:非金属性越强,其对应的最低价非金属氢化物越稳定。
①.同周期非金属元素原子序数越大非金属性越强,非金属性越强对应的最低价氢化物的稳定性越强:HF>H2O>NH3>CH4 ;HCl>H2S>PH3>SiH4 。
②.同主族非金属元素原子序数越小非金属性越强,非金属性越强对应的最低价氢化物的稳定性越强:HF>HCl>HBr>HI ;H2O>H2S>H2Se>H2Te ;NH3>PH3>AsH3 ;CH4>SiH4>GeH4 。
1.(海南化学卷第10题 3分)门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
4.(★★★★★)已知 NH3 和 Cl2 相遇,发生下列反应:
①8NH3+3Cl2 ==== N2+6NH4Cl (NH3过量)
②2NH3+3Cl2==== N2+6HCl (Cl2过量)
今向过量的 NH3 中通入少量的 Cl2。若开始时 Cl2、NH3 混和气体中 Cl2 的体积分数为 x,混合气体反应前后的体积分别是 a L 和 y L。则:
(1)x 的取值范围是__________________;
(2)y 与x 的函数关系是__________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com