
4.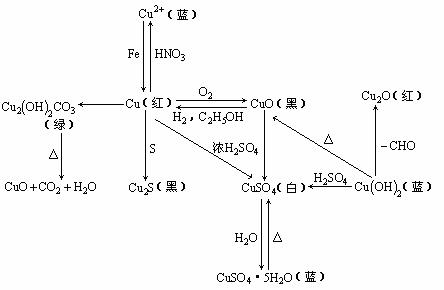 铜及其化合物之间的转化关系:
铜及其化合物之间的转化关系:
例3. 在铁与铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,则m1与m2之间的关系是( )
(A)m1一定大于m2 (B)m1可能m2
(C)m1一定等于m2 (D)m1可能大于m2
解析 铁和铜的混合物与一定量的硝酸反应,当金属剩余时,硝酸耗尽,但生成物中有硝酸亚铁或硝酸铜或这两种物质的混合物。若再向其中加入稀硫酸,则继续发生如下反应:
3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O
或:3Fe +8H++2NO3- = 3Fe2++2NO↑+4H2O
Fe +4H++NO3- = Fe2++NO↑+2H2O
使金属质量减少。所以m1一定大于m2。所以答案为A。
3.铜的化合物的化学性质
(1) 氧化铜
a. 氧化铜有金属氧化物的性质,例如:
CuO+2HCl= CuCl2 +H2O
b. 氧化铜具有氧化性,可与某些还原剂反应。例如:
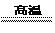
 H2 +CuO Cu+ H2O
H2 +CuO Cu+ H2O
 C +2CuO 2Cu+ CO2
↑
C +2CuO 2Cu+ CO2
↑
c. 氧化铜在高温下可发生分解反应: 4CuO 2Cu2O+ O2 ↑
|
实验内容 |
实验现象 |
结论 |
产物推测 |
|
用酒精灯加热装在试管中的CuO,收集生成的气体 |
黑色固体变为红色固体,收集的气体可使带火星的木条复燃 |
4CuO=Cu2O+O2↑(高温条件反应) |
CuO发生分解反应,红色固体为Cu2O,气体可使带火星的木条复燃 |
(2) 硫酸铜
CuSO4 晶体与无水CuSO4 之间可以相互转化
CuSO4·5H2O  CuSO4 + 5H2O
CuSO4 + 5H2O
CuSO4 + 5H2O = CuSO4·5H2O
|
|
实验内容 |
实验现象 |
结论 |
|
CuSO4·5H2O → CuSO4 |
向饱和的CuSO4 溶液中慢慢滴入浓硫酸,静置 |
液体分为两层,上层蓝色,下层无色,有白色固体析出 |
浓硫酸具有吸水性,可使饱和的CuSO4 溶液析出白色CuSO4 固体 |
|
CuSO4→ CuSO4·5H2O |
向无水CuSO4 中通入水蒸气 |
白色粉末变为蓝色晶体 |
CuSO4+5H2O= CuSO4·5H2O |
2.铜的化学性质
 (1) 与非金属单质反应
(1) 与非金属单质反应

 2Cu+O2 2CuO 2 Cu+S Cu2S Cu+Cl2 CuCl2
2Cu+O2 2CuO 2 Cu+S Cu2S Cu+Cl2 CuCl2
(2) 与酸反应
a. 与非氧化性酸(稀盐酸、稀硫酸)不反应。
b. 与氧化性酸反应
Cu + 2H2SO4(浓)  CuSO4 + SO2 ↑+ 2H2O
CuSO4 + SO2 ↑+ 2H2O
Cu + 4HNO3 (浓) = Cu(NO3)2 + 2NO2 ↑+ 2H2O
3Cu + 8HNO3 (稀) = 3Cu(NO3)2 +2 NO ↑+ 4H2O
(3) 与盐溶液反应
Cu+2FeCl3 = CuCl2 +2FeCl2
(4) 铜在干燥空气中性质稳定,但在潮湿空气中会被腐蚀,在其表面逐渐形成一层绿色的铜锈。
2Cu+ O2 +H2O + CO2 = Cu2(OH)2CO3
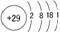 铜是人类发现最早的金属之一,也是最好的纯金属之一。铜元素在元素周期表中位于第四周期第ⅠB族,原子结构示意图为:
铜是人类发现最早的金属之一,也是最好的纯金属之一。铜元素在元素周期表中位于第四周期第ⅠB族,原子结构示意图为:
电子排布式为:1s22s22p63s23p63d104s1
1.铜及其化合物的颜色
铜是硬度较小的紫红色金属,具有良好的延展性、导电性和导热性
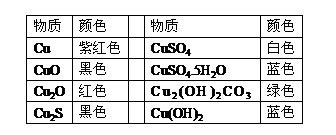
7.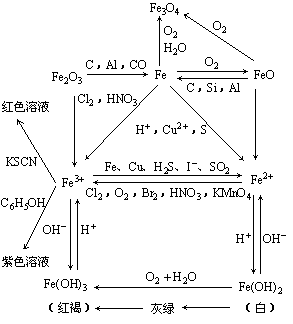 铁及其化合物之间的转化关系:
铁及其化合物之间的转化关系:
6.进行铁及其化合物的计算时应注意的事项:
(1)铁元素有变价特点,要正确判断产物;
(2)铁及其化合物可能参加多个反应,要正确选择反应物及反应的化学方程式;
(3)反应中生成的铁化合物又可能与过量的铁反应,因此要仔细分析铁及其化合物在反应中是过量、适量,还是不足量;
(4)当根据化学方程式或离子方程式计算时,找出已知量与未知量的关系,列出方程式或方程式组;
(5)经常用到差量法、守恒法.
5.Fe2+、Fe3+的检验
(1)Fe2+的检验方法:
①含有Fe2+的溶液呈浅绿色;
②向待检液中滴加NaOH溶液或氨水,产生白色絮状沉淀,露置在空气中一段时间后,沉淀变为灰绿色,最后变为红褐色,说明含Fe2+.
③向待检液中先滴加KSCN溶液,无变化,再滴加新制的氯水,溶液显红色,说明含Fe2+.有关的离子方程式为:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl- Fe3+ + 3SCN- = Fe(SCN)3
(2)Fe3+的检验方法:
①含有Fe3+的溶液呈黄色;
②向待检液中滴加NaOH溶液或氨水,产生红褐色沉淀,说明含Fe3+.
③向待检液中滴加KSCN溶液,溶液呈血红色,说明含Fe3+.
④向待检液中滴加苯酚溶液,溶液呈紫色,说明含Fe3+
4.+2价铁的化合物与+3价铁的化合物的相互转换
例如:2Fe3+ + Fe = 3Fe2+
应用:①除去亚铁盐(含Fe2+)溶液中混有的Fe3+;②亚铁盐很容易被空气中的O2氧化成铁盐,为防止氧化,可向亚铁盐溶液中加入一定量的铁屑.
例如:2Fe2++ Cl2=2Fe3++ 2Cl-
应用:氯化铁溶液中混有氯化亚铁时,可向溶液中通入足量氯气或滴加新制的氯水,除去Fe2+离子.
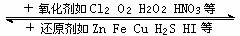
Fe2+ Fe3+
例1 制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 A.烧杯中有铜无铁 B.烧杯中有铁无铜 C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
思路分析:向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,由于Fe的还原性比Cu强,Fe3+首先应与Fe反应,如果Fe3+有剩余,剩余的Fe3+再与Cu反应。铁粉未反应完时铜粉就不会被氧化,所以不可能出现烧杯中有铁无铜的现象,故应选B。其他三个选项的情况都可能再现。当FeCl3过量或恰好完全反应时,Fe、Cu均无剩余,即选项D,反应后溶液中有Fe3+、Fe2+、Cu2+或Fe2+、Cu2+。当FeCl3不足量时,有两种情况:①Fe粉有剩余,则Cu尚未参加反应,即选项C,反应后溶液中只有Fe2+(不考虑H+、OH-);②铁粉无剩余,则Cu反应了一部分或尚未参加反应,即选项A,反应后溶液中有Fe2+、Cu2+或只有Fe2+。答案:B
方法要领:此题涉及氧化还原反应的一个规律:当一种氧化剂氧化几种还原剂时,首先氧化最强的还原剂,待最强的还原剂完全氧化后,多余的氧化剂再依次氧化次强的还原剂。一种还原剂还原几种氧化剂时与此类似。
金属越活泼,还原性越强,不过对变价金属所形成的中间价态的阳离子与高价态的阳离子其氧化性是不同的。常见的金属阳离子氧化性顺序为:
K+<Na+<Mg2+<Al3+<Zn2+<Fe2+<Cu2+<Fe3+<Hg2+<Ag+
由上表知,Fe3+的氧化性比Cu2+强,才会发生题中介绍的印刷电路腐蚀原理的反应。
例2 在由Fe、FeO、和Fe2O3组成的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是(1997年上海高考题)
A.混合物里3种物质反应时消耗盐盐酸的物质的量浓度之比为1:1:3
B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:2
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
思路分析:根据题意,n(HCl)=0.2mol,生成n(H2)=0.448L/22.4L.mol-1=0.02mol。
因氧化性:Fe3+>H+,所以Fe先与Fe3+反应后再还原H+,由Fe+2Fe3+=3Fe2+(1molFe还原1mol Fe2O3),和Fe与H+反应放出H2,可知n(Fe)>n(Fe2O3);由反应后溶液中溶质全为FeCl2知,n(Fe2+):n(Cl-)=1:2;至于混合物中Fe、Fe2O3及FeO之间量的关系,无从知道。
答案:B、C
3.铁的氢氧化物:
|
|
氢氧化亚铁(Fe(OH)2) |
氢氧化铁- Fe(OH)3 |
|
色态 |
白色固体 |
红褐色固体 |
|
水溶性 |
难溶于水 |
|
|
与酸反应 |
Fe(OH)2 + 2H+ = Fe2+
+ 2H2O |
Fe(OH)3 + 3H+ = Fe3+
+ 3H2O |
|
与强氧化酸反应 |
3Fe(OH)2 + 10HNO3 =
3Fe(NO3)3 + NO↑+8H2O |
Fe(OH)3 + 3H+ = Fe3+
+ 3H2O |
|
稳定性 |
不稳定,易被空气中的氧气氧化,颜色变化:白色→灰绿色→红褐色 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 |
较稳定空气中久置会部分失水成铁锈受热易分解 |
|
制取 |
新制FeSO4溶液与NaOH溶液隔绝空气反应:Fe2+ + 2OH-
= Fe(OH)2↓ |
铁盐与可溶性碱反应 Fe3+ + 3OH- = Fe(OH)3↓ |
思考:①实验中为什么要用新制的硫酸亚铁溶液?
(防止硫酸亚铁被空气中的氧气氧化而影响效果)
②怎样才能使Fe2+溶液长时间保存?
(在配制溶液时,要加入少量铁粉防止氧化,加入少量对应酸抑制水解)
③实验中为什么要将滴管尖端插入试管里溶液底部,慢慢挤出氢氧化钠溶液
(氢氧化亚铁极易被氧化,溶解在水中的少量的氧气都能将它氧化成氢氧化铁,所以按一般强碱与弱酸盐反应制弱碱的操作很难得到。要制得白色溶液必须用加热煮沸过的蒸馏水(以减少溶解在水中的氧气)临时配制硫酸亚铁溶液,最好在溶液中再滴几滴植物油以避免硫酸亚铁溶液与空气接触,准备加入的氢氧化钠溶液也要先加热煮沸,并且滴管尖嘴要伸入硫酸亚铁溶液的底部再慢慢挤,以防止带入氧气)
2.铁的氧化物:
铁的氧化物有三种:氧化亚铁、氧化铁、四氧化三铁
|
|
FeO |
Fe2O3(铁红) |
Fe3O4(磁性氧化铁) |
|
化合价 |
+2 |
+2 |
+2、+3 |
|
色、态 |
黑色粉未 |
红棕色粉未 |
黑色晶体 |
|
水溶性 |
均不溶于水 |
||
|
和弱氧化性酸反应 |
FeO + 2H+ = Fe2+ +
H2O |
Fe2O3 + 6H+
= 2Fe3+ + 3H2O |
Fe3O4 + 8H+
= 2Fe3+ + Fe2+ + 4H2O |
|
和强氧化性酸反应 |
3FeO + 10HNO3(稀) = 3Fe(NO3)3
+ NO↑+ 5H2O
|
Fe2O3 + 6HNO3
= 2Fe(NO3)3 + 3H2O |
3 Fe3O4 + 28HNO3
= 9 Fe(NO3)3 + NO↑+14H2O |
|
稳定性 |
在空气中氧化为Fe3O4 |
空气中稳定 |
在空气中稳定 |
|
制备 |
高温熔融,过量的铁与O2反应:2Fe+O2=2FeO |
氢氧化铁加热分解 2Fe(OH)3=Fe2O3+3H2O |
铁在氧气中燃烧 3Fe + 2O2 = Fe3O4 |
注意:①FeO与非氧化性酸相遇时,发生复分解反应,生成亚铁盐;但与强氧化性酸相遇,Fe2+被氧化成Fe3+,生成铁盐
②Fe3O4在三种氧化物中最为稳定,一般不与酸、碱和氧气反应,所以在铁的表面若能形成Fe3O4膜,便能起到保护作用,防止生锈。Fe3O4是一种复杂的氧化物,它不属于碱性氧化物,可以写成FeO·Fe2O3的形式有+2、+3 价
③FeO、Fe2O3是碱性氧化物
④空气中:6FeO + O2 = 2Fe3O4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com