
13]某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加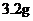 ,所得溶液中
,所得溶液中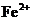 和
和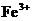 物质的量之比是( )
物质的量之比是( )
 A.
1:1 B.
2:1 C.
3:2 D.
4:1
A.
1:1 B.
2:1 C.
3:2 D.
4:1
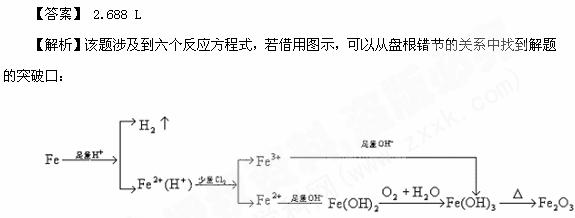 [14]把适量的铁粉投入到足量的盐酸中,充分反应后,向溶液中通入少量的氯气,然后加入过量的烧碱溶液,这时有沉淀生成,充分搅拌后过滤,将沉淀洗涤加强热最终得到残留物为9.6g。试求:铁粉与盐酸反应时放出氢气的体积(标准状况下)。
[14]把适量的铁粉投入到足量的盐酸中,充分反应后,向溶液中通入少量的氯气,然后加入过量的烧碱溶液,这时有沉淀生成,充分搅拌后过滤,将沉淀洗涤加强热最终得到残留物为9.6g。试求:铁粉与盐酸反应时放出氢气的体积(标准状况下)。

 [15]在
[15]在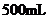
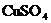 和
和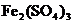 的混合液中加入21.7g铁粉,待反应完全后,得到16.8g残留固体。向滤液中加入400mL 4mol/L的
的混合液中加入21.7g铁粉,待反应完全后,得到16.8g残留固体。向滤液中加入400mL 4mol/L的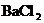 溶液,恰好使溶液中的
溶液,恰好使溶液中的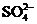 完全沉淀。求原混合液中
完全沉淀。求原混合液中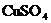 和
和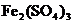 的物质的量浓度。
的物质的量浓度。
11]准确称取6g铝土矿样品(含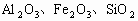 )放入盛有100mL某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入
)放入盛有100mL某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入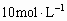 的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如下图所示。请回答:
的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如下图所示。请回答:
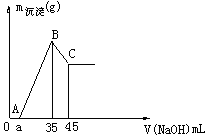
(1)硫酸的物质的量浓度为_______________。
(2)若a=2.3,用于沉淀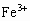 所消耗的NaOH溶液的体积是_________mL,铝土矿中各组成成分的质量分数:
所消耗的NaOH溶液的体积是_________mL,铝土矿中各组成成分的质量分数: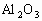 为_________,
为_________,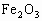 为_________,
为_________,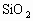 为_________。
为_________。
(3)a值的范围应是_________,在这个范围内,a值越大,_________的质量分数越小。
 [12]向一定物质的量的
[12]向一定物质的量的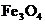 和Fe的混合物中加入
和Fe的混合物中加入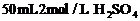 溶液,在一定条件下恰好使混合物完全溶解,放出448mL(标准状况下)的气体。向所得溶液中加入KSCN溶液,无红色出现。则用足量的CO在高温下与相同质量的此混合物充分反应,能得到铁多少克?
溶液,在一定条件下恰好使混合物完全溶解,放出448mL(标准状况下)的气体。向所得溶液中加入KSCN溶液,无红色出现。则用足量的CO在高温下与相同质量的此混合物充分反应,能得到铁多少克?

[易错点点睛]所谓终态法就是指不考虑反应的中间过程,只考虑最终结果,抓住某些特定量之间的关系,列出等式,巧妙解题。对于有些看似复杂的计算题,运用此法,往往能达到事半功倍的效果。
10]甲、乙两烧杯中各盛有100mL 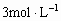 的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙=1:2,则加入铝粉的质量为( )
的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙=1:2,则加入铝粉的质量为( )
 A. 5.4g
B. 3.6g C.
2.7g D. 1.8g
A. 5.4g
B. 3.6g C.
2.7g D. 1.8g
9]已知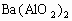 可溶于水。下图表示的是向
可溶于水。下图表示的是向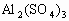 溶液中逐滴加入
溶液中逐滴加入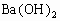 溶液时,生成沉淀的物质的量y与加入
溶液时,生成沉淀的物质的量y与加入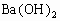 的物质的量x的关系。下列有关叙述正确的是( )
的物质的量x的关系。下列有关叙述正确的是( )
A. A-D时沉淀的物质的量: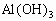 比
比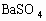 多
多
B. C-D时溶液中离子的物质的量: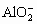 比
比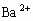 多
多
C. A-D时沉淀的物质的量: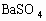 可能小于
可能小于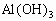
D. D-E时溶液中离子的物质的量: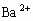 可能等于
可能等于
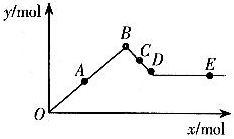
 [答案] BD
[答案] BD
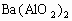 与
与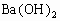 的物质的量之比达到1:1时,就有
的物质的量之比达到1:1时,就有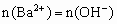 ,D正确。
,D正确。
[易错点点睛]注意图像的起点、拐点、终点所表示的的意义。
8]在浓度为0.01mol/L Mg(HCO3)2,0.02mol/LCaCl2的水溶液1L中,要同时除去Mg2+,Ca2+应选用的试剂是( )
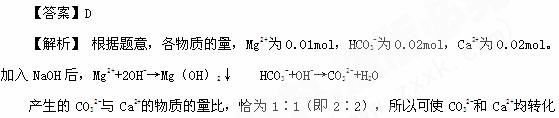 A.NaHCO3 B.Na2CO3 C.Ca(OH)2 D.NaOH
A.NaHCO3 B.Na2CO3 C.Ca(OH)2 D.NaOH
CaCO3沉淀中。
[易错点点睛]若只考虑加入Ca(OH)2后,OH-使Mg2+沉淀,HCO3-转化为CO32-后使Ca2+沉淀,而未涉及题设的Mg2+和Ca2+的物质的量比而出现误选C。
5] 将4.7g某两金属混合物与100mL盐酸(浓度为4mol/L)反应。当盐酸耗尽后,还有少量的金属未溶解,则两金属可能是( )
A.Na和Ca B.Mg和Al C.Zn和Fe
D.Fe和Sn
 [6] 在铝土矿(Al2O3·H2O和Al2O3·3H2O为主)中有杂质Fe2O3和SiO2 ,为除去砂和氧化铁,有两种设计方案:
[6] 在铝土矿(Al2O3·H2O和Al2O3·3H2O为主)中有杂质Fe2O3和SiO2 ,为除去砂和氧化铁,有两种设计方案:
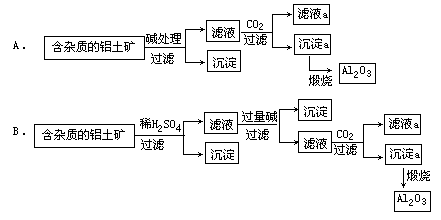


(1)所设计的两种方案中,合理而又考虑经济效益的是(填编号)______。
(2)若提纯时用的原料除铝土矿、水外,在下列物质中选择:①Na2CO3②CaCO3③H2SO4④HCl⑤KOH。试写出有关主要反应的化学方程式,但溶液中的离子反应要写离子方程式。
[答案](1)B 
(2)Al2O3+2OH-→2AlO2-+H2O
 [7] 在铝的氮化物制备时,用氧化铝、碳和氮气于高温可制得AlN。已知AlN是具高熔点、高硬度、难溶于水和一般溶剂的绝缘性良好的晶体。试回答:
[7] 在铝的氮化物制备时,用氧化铝、碳和氮气于高温可制得AlN。已知AlN是具高熔点、高硬度、难溶于水和一般溶剂的绝缘性良好的晶体。试回答:
(1)写出上述制取AlN的化学方程式。
 (2)AlN属于哪种晶体的基本类型,铝与氮之间以哪种化学键相结合
(2)AlN属于哪种晶体的基本类型,铝与氮之间以哪种化学键相结合
4]一些能在溶液中大量共存的离子组的混合溶液,向其中加入NaOH溶液时,沉淀量与加入NaOH溶液的体积关系如图1-8-1曲线所示。其中符合此曲线的离子组是( )
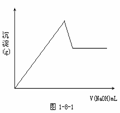 A.Al3+,Ba2+,H2PO4-,Cl-
A.Al3+,Ba2+,H2PO4-,Cl-
B.Mg2+,Al3+,NO3-,Br-
C.Be2+,Al3+,H+,Cl-
D.H+,Al3+,Cu2+,S2-
 [答案]A
[答案]A 
3] 在 0.1mol/L明矾溶液 100mL中,加入0.1mol/L的 Ba(OH)2溶液,当SO42-恰好沉淀完全时,同时得到的氢氧化铝的物质的量为( )
A.0.01mol B.0.005mol 
 C.0.0133mol
D.0.0mol
C.0.0133mol
D.0.0mol 
0. 8/1.5=0.533(L)。错误未考虑Al3+也与OH-的反应。正确的应使Al3+完全转化为AlO2-后,Mg(OH)2才能从溶液中滤出。
8/1.5=0.533(L)。错误未考虑Al3+也与OH-的反应。正确的应使Al3+完全转化为AlO2-后,Mg(OH)2才能从溶液中滤出。
2]在200mL MgCl2,AlCl3的混合溶液中,浓度为:MgCl2 2mol/L,AlCl3
3mol/L。现欲使其中的Mg2+转化为Mg(OH)2沉淀而从溶液中分离出来,至少需要1.5mol/LNaOH溶液的体积是( )
A.0.533L B.0.267L C.1.0L D.2.0L 
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com