
14.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是
A.稀盐酸 Na2CO3溶液 B.AlCl3溶液 NaAlO2溶液
C.Fe HNO3溶液 D.浓氨水 AgNO3溶液
13.下列叙述正确的是
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.有单质参加或生成的反应一定属于氧化还原反应
C.失电子难的原子,获得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
12.在下列各说法中,正确的是
A.△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
11.在一个体积可变的密闭容器中,盛有等物质的量的SO2、O2、SO3(g)的混合气体,在一定温度和压强下,反应达到平衡时,容器中混合气体的密度比反应前减少了1/13(温度、压强反应前后不变),则反应达到平衡时,混合气体中SO2占总体积的
A.1/3 B.1/6 C.2/13 D.6/13
10.右图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol·L-1, 工作一段时间后,测得导线上都通过了
 0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是
0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上析出物质的质量:①<②
C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;
②中负极:2H++2e一=H2↑
D.溶液的pH:①不变;②增大
9.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家HenkVan Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是
A.Fe2+、K+、Cl- 、NO3- B.NH4+、Fe2+、 I一、SO42-
C.Na+ 、K+、ClO-、S2- D.Na+、S2O32-、AlO2- 、K+
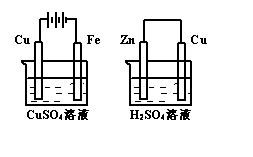
8.类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中不正确的是
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成2PbO·PbO2
C.不能用电解熔融AlCl3来制取金属铝;也不用电解熔融MgCl2来制取金属镁
D.Fe与S直接化合生成FeS;Cu与S直接化合也可以得到Cu2S
7.下列离子方程式不正确的是
A.NaHS溶液中通入足量氯气:HS-+Cl2 ==S↓+H++2Cl-
B.用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O ==2HCO3-+SO32-
C.硫化钠溶于水中:S2-+2H2O  H2S↑+2OH-
H2S↑+2OH-
D.将少量氯气通入溴化亚铁溶液中:2Fe2++Cl2==2Fe3++2Cl-
6.设NA表示阿伏加德罗常数,下列说法中正确的是
A.1mol甲基正离子(CH3+)所含电子数为8NA
B.在反应CaO+3C高温CaC2+CO↑中,若生成1molCO,则转移电子数为3 NA
C.由2H和18O所组成的水11g,其中所含的中子数为5NA
D.SiO2晶体中,1mol硅原子形成2NA个Si-O共价键
5.硝酸铵(NH4NO3)在不同条件下分解可以得到不同的产物,下列各组物质中肯定不可能是硝酸铵分解产物的是
A.N2O、H2O B.N2、O2、H2O C.N2、HNO3、H2O D.NH3、NO、H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com