
19.[湘西南名校联盟2009年2月高三联合考试试卷]某有机物结构简式为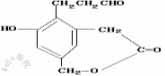 该有机物酸性条件下水解后的生成物分别与金属钠,氢氧化钠,新制氢氧化铜发生反应,从理论上计算出1mol生成物分别与上述三种无机物反应消耗的物质的量 的比为
( C )
该有机物酸性条件下水解后的生成物分别与金属钠,氢氧化钠,新制氢氧化铜发生反应,从理论上计算出1mol生成物分别与上述三种无机物反应消耗的物质的量 的比为
( C )
A.1:1:1 B .3:2:2 C .3:2:3 D.6:4:5
18.[湘西南名校联盟2009年2月高三联合考试试卷]下列表格中的各种情况,可以用下面的图象曲线表示的是[A]
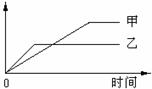
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
等质量钾、钠分别与足量水反应 |
H 2质量 |
钠 |
钾 |
|
B |
相同质量氨,在同一容器中 2NH3 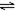 N2+3H2 N2+3H2 |
氨气的转化率 |
500℃ |
400℃ |
|
C |
在体积可变的恒压容器中,体积比1:3的N2、H2,N2+3H2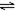 2NH3 2NH3 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
|
D |
2molSO2与lmolO2,在相同温度下2SO2+O2 2SO3 2SO3 |
SO3物质的量 |
10个大气压 |
2个大气压 |
17.[西安中学2009届高三第三次年级统考](6分) 2008年9月11日,三鹿牌婴幼儿奶粉因非法加入化工原料,致使服用有毒奶粉而接受治疗的婴幼儿数量已经增加到接近53000人,这些婴儿中虽然不是所有人都已患病,但有13000名婴儿必须住院接受治疗。此外,还有39965名婴儿在门诊接受了治疗之后已经治愈。根据卫生部公布的数字,还有104名婴儿病重。到9月24日为止,已经有四名婴儿因为肾结石不治身亡。经调查,该化工原料为三聚氰胺。因其中含氮,并且无色无味,被不法商贩用于提高奶粉的含氮量,造成蛋白质含量高的假象。三聚氰胺最早被德国化学家李比希于1834年合成。其分子组成中只含有碳、氮、氢三种元素,相对分子质量是126。现称取1.26g三聚氰胺在足量的氧气中完全燃烧,将燃烧产物通过盛有浓硫酸的洗气瓶,浓硫酸增重0.54g,再将剩余气体通过盛有碱石灰的干燥管,干燥管增重1.32g,最后剩余一种空气中含有的气体。根据以上条件确定三聚氰胺的分子式。
答案(6分)C3N6H6
16.[西安中学2009届高三第三次年级统考](15分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
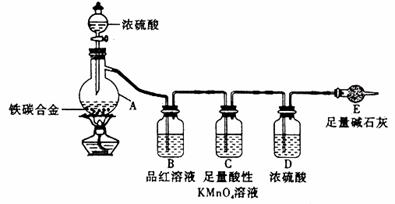
Ⅰ 探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为________。
未点燃酒精灯前,A、B均无明显现象,其原因是:____ _。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式_____________________________________(只写一个)。
B中的现象是______________,由此可得到浓硫酸具有____________性。
 (4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式________________________________(只写一个)。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式________________________________(只写一个)。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式)。
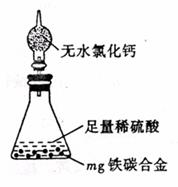
(7)某同学认为上述方法较复杂,使用右图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是_________________(填写代号)。
A. 用排水法测定H2的体积
B. 反应结束后,过滤、洗涤、干燥、称量残渣的质量
C. 测定反应前后装置和药品的总质量。
答案(2)蒸馏烧瓶 ;常温下,Fe被浓硫酸钝化,碳不与浓硫酸反应
(3)2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
(或C+2H2SO4(浓)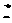 CO2↑+2SO2↑+2H2O)品红溶液逐渐褪色 强氧化
CO2↑+2SO2↑+2H2O)品红溶液逐渐褪色 强氧化
(4)2Fe3++Fe==3Fe2+(或Fe+2H+==Fe2++H2↑)
(5)铁碳在溶液中形成原电池
(6)×100%(或×100%或×100%) (7)B
14、[广东梅州五华县横陂中学2009届高考模拟测试.2月](8分)某中学化学教材上有如下介绍:“在氢氧化钠浓溶液中加入氧化钙,加热,制得白色固体就是碱石灰,它是水和二氧化碳的吸收剂”。有两个实验小组决定通过实验来探究碱石灰的组成。
(1)第一小组设计的实验方案如下:
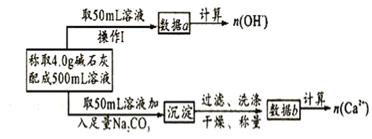
下列关于溶液中n(OH-)、n(Ca2+)、n(Na+)之间的关系式正确的是________
A. n(Na+)+ 2n(Ca2+)= n(OH-) B. 2n(Na+) + 2n(Ca2+)= n(OH-)
C. n(Na+)+ n(Ca2+)= 2n(OH-)
现有4.0g碱石灰,设其中n(Na+)= xmol, n(Ca2+)= ymol,请填写下列空格:
|
碱石灰的可能组成 |
NaOH, CaO |
NaOH, CaO, Ca(OH)2 |
NaOH, Ca(OH)2 |
NaOH, Ca(OH)2 H2O |
|
x,y之间关系式(等式或不等式) |
A |
40x+56y﹤4.0﹤ 40x+74y |
B |
C |
把表中A、C的关系式填在下面空格上:
A:__________________________C:______________________ 。
(2)第二小组查得如下资料:氢氧化钙在250℃时不分解,高于250℃时才分解;氢氧化钠在580℃时不分解。他们设计了如下方案并得出相应相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,测得固体质量又减少了0.7g.请通过计算确定该碱石灰各成分的质量分数?(要计算过程)
答案. (8分) (1)(4分)A A:40x+56y=4.0 C:40x+74y﹤4.0
(2) (4分)NaOH%=13% Ca(OH)2%=72% H2O%=15%19. [西安中学2009届高三第三次年级统考]14g铜金合金与足量的某浓度HNO3反应,将产生的气体用1.12L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为 [B ]
A.9.6g B.6.4g C.3.2g D.1.6g
15[西安中学2009届高三第三次年级统考].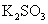 易被
易被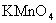 等强氧化剂氧化,现将18mL 0.2mol/L的
等强氧化剂氧化,现将18mL 0.2mol/L的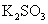 溶液与含有
溶液与含有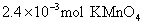 溶液混合,正好完全反应。则锰元素的最高价态为[B]
溶液混合,正好完全反应。则锰元素的最高价态为[B]
(A)+6 (B)+4 (C)+2 (D)+7
13.[广东梅州五华县横陂中学2009届高考模拟测试.2月] (10分) 2008年我国南方地区遭受了历史上罕见的特大的冰雪,交通堵塞,电网中断,给群众的生活带来很多困难。化学试剂氯化钙作为融雪剂在抗雪灾中起了一定的作用。氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312 g,放入烧杯中,加入适量6 mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35.00 mL 0.25 mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05 mol/L KMnO4溶液16 .00mL,恰好完全反应。
回答下列问题:
(1)配平: MnO4-+ H2C2O4+ H+― Mn2++ CO2↑+ H2O
(2)0.05mol·L-1KMnO4标准溶液应置于 (选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为 。
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)。
答案. (10分) (1)2、5、6、2、10、8 (2分)
(2)酸式(2分) 当看到滴入1滴KMnO4溶液时,锥形瓶中溶液立即变成紫红色,且半分钟内不褪色,即达到滴定终点。(2分)
(3)34.60% (4分)
12.[湖北天门中学2008-2009学年度高三年级第三次月考](8分)将Cu与CuO的混合物20.8g,加入到50mL 18.4mol/L浓H2SO4中,加热充分反
应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)=0.3 mol/L。试计算:
(1)若不考虑气体在溶液中的溶解,反应过程中放出的气体在标况下的体积为: L。
(2)溶液稀释后,溶液中c(H+)为: 。
答案.(8分)解:有关化学方程式:
① CuO + H2SO4 == CuSO4 + H2O
②
Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
设混合物中Cu的物质的量为x,CuO的物质的量为y。
64x + 80y =20.8……①
x + y =0.3……②
解得:x=0.2mol y=0.1mol
(1)V(SO2)=0.2mol×22.4L/mol = 4.48L
(2)n(H2SO4)总=0.05L×18.4mol/L=0.92mol, n(H2SO4)耗=2x + y=0.5mol
n(H2SO4)余=0.92mol-0.5mol=0.42mol
c(H +)=0.42mol×2÷1L=0.84mol/L
11.[湖北天门中学2008-2009学年度高三年级第三次月考] 在100 mL 0.10 mol/L的AgNO3溶液中加入100 mL溶有0.01mol BaCl2的溶液,再加入100 mL溶有0.01mol CuSO4·5H2O的溶液,充分反应。下列说法中正确的是 [D]
A.最终得到白色沉淀和无色溶液 B.在最终得到的溶液中Cl-的物质的量为0.02 mol
C.在最终得到的溶液中,Cu2+的物质的量浓度为0.01 mol/L
D.最终得到的白色沉淀是等物质的量的两种化合物的混合物
10.[湖北天门中学2008-2009学年度高三年级第三次月考]在给定条件下,下列加点的物质在化学反应中完全消耗的是[A]
A.向100mL 3mol/L的硝酸中加入5.6g铁
B.用50mL 8mol/L的浓盐酸与10g二氧化锰共热制取氯气
C.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中
D.在50MPa、500℃和铁触媒催化的条件下,用1.2mol氮气和3mol氢气合成氨
9.[唐山一中2008-2009学年度高三第一学期期中考试]0.04mol KMnO4固体,加热一段时间后,收集到amol气体,在反应后的残留固体中加入足量的浓盐酸,又收集到bmol气体,设此时Mn元素全部以Mn2+存在于溶液中,则:
(1)a+b的取值范围为 ;
(2)计算若a+b=0.09mol时,残留固体的质量为多少克?
答案.(1)0.08≤a+b<0.1 (2)6g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com