
7.浓硝酸受热分解:4HNO3=4NO2↑+O2↑+2H2O,该反应中被氧化的氧元素与被还原的氮元素的原子个数比是
A.1:2 B.2:1 C.1:1 D.1:4
6.在反应3NO2+H2O=2HNO3+NO中,NO2的作用是
A.只作氧化剂 B.既是氧化剂又是还原剂
C.只作还原剂 D.既不是氧化剂也不是还原剂
5.工业上制造金刚砂(SiC)的化学方程式是SiO2+3C==SiC+2CO↑,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比是
A.1︰2 B.2︰1 C.1︰1 D.3︰5
4.氢阴离子(H-)能和NH3反应:H- + NH3 = NH2- + H2↑根据上述反应事实可以得出的正确结论是
A.NH3有还原性 B. H-是很强的还原剂
C.该反应的还原产物是H2 D. 该反应属于置换反应
3.单质X和Y相互反应生成化合物XY(其中X为+2价,Y为-2价)。下列叙述中,正确①X被氧化;②X是氧化剂;③X具有氧化性;④XY既是氧化产物也是还原产物;⑤XY中的Y2-具有还原性;⑥XY中X2+具有氧化性;⑦Y的氧化性比XY中的X2+的氧化性强
A.①④⑤⑥⑦ B.①③④⑤ C.②④⑤ D.①②⑤⑥⑦
2.离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X- +3S2- +14H+==2M3+ +3Sœ +7H2O,则M2O7X-中M的化合价为
A.+4 B.+5 C.+6 D.+7
1.根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
A. X > Z > Y > W B. Z > W > X > Y
C. Z > Y > X > W D. Z > X > Y > W
15.tanθ=y/x=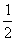 gt2/v0t=
gt2/v0t=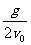 t,设速度与水平方向的夹角为β,则tanβ=
t,设速度与水平方向的夹角为β,则tanβ=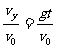 由以上两式解得tanβ=2tanθ,速度与斜面的夹角α=β-θ=tan-1(2tanθ)-θ与抛出时的初速度大小无关,因此α1=α2.
由以上两式解得tanβ=2tanθ,速度与斜面的夹角α=β-θ=tan-1(2tanθ)-θ与抛出时的初速度大小无关,因此α1=α2.
vg=gt=100 m/s t′=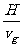 =9.7 s s=v0(t+t′)=1970 m
=9.7 s s=v0(t+t′)=1970 m
14.由几何知识可知: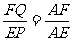 ,由平抛规律可得:EP=
,由平抛规律可得:EP=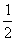 gt2,AE=v0t,AF=v0.小球刚好落在墙角处,则有:s=FQ?=
gt2,AE=v0t,AF=v0.小球刚好落在墙角处,则有:s=FQ?=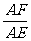 ·EP=(v0
·EP=(v0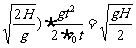 t
t
由此可知:小球影子以速度v=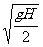 沿墙向下做匀速运动.
沿墙向下做匀速运动.
15.(12分)如图1-4-7所示,从倾角为θ的斜面上的某点先后将同一小球以不同的初速度水平抛出,均落到斜面上.当抛出的速度为v1时,小球到达斜面时的速度方向与斜面的夹角为α1,当抛出时的速度为v2时,小球到达斜面时的速度方向与斜面的夹角为α2.试通过计算说明α1、α2的大小关系. 参考答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com