
4.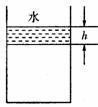 江苏省南师大附属扬子中学2010届高三周练实验室内,某同学用导热性能良好的气缸和活塞将一定质量的理想气体密封在气缸内(活塞与气缸壁之间无摩擦),活塞的质量为m,气缸内部的横截面积为S.用滴管将水缓慢滴注在活塞上,最终水层的高度为h,如图所示.在此过程中,若大气压强恒为p0,室内的温度不变,水的密度为
江苏省南师大附属扬子中学2010届高三周练实验室内,某同学用导热性能良好的气缸和活塞将一定质量的理想气体密封在气缸内(活塞与气缸壁之间无摩擦),活塞的质量为m,气缸内部的横截面积为S.用滴管将水缓慢滴注在活塞上,最终水层的高度为h,如图所示.在此过程中,若大气压强恒为p0,室内的温度不变,水的密度为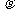 ,重力加速度为g,则:
,重力加速度为g,则:
①图示状态气缸内气体的压强为 ;
②以下图象中能反映密闭气体状态变化过程的是 .
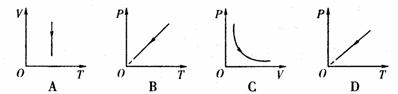
答案:①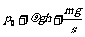 ②A
②A
3.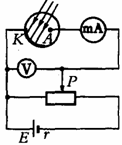 江苏省淮阴中学2010届高三摸底考试如图所示的实验电路,当用黄光照射光电管中的碱金属涂层时,毫安表的指针发生了偏转.若将电路中的滑动变阻器的滑片P向右移动到某一位置时,毫安表的读数恰好减小到零,此时电压表读数为U。若此时增加黄光照射的强度,则毫安表
▲ (选填“有”或“无”)示数.若改用蓝光照射光电管中的金属涂层,则毫安表
▲ (选填“有”或“无”)示数。
江苏省淮阴中学2010届高三摸底考试如图所示的实验电路,当用黄光照射光电管中的碱金属涂层时,毫安表的指针发生了偏转.若将电路中的滑动变阻器的滑片P向右移动到某一位置时,毫安表的读数恰好减小到零,此时电压表读数为U。若此时增加黄光照射的强度,则毫安表
▲ (选填“有”或“无”)示数.若改用蓝光照射光电管中的金属涂层,则毫安表
▲ (选填“有”或“无”)示数。
答案:无;有
2. 贵州省兴义市清华实验学校2010届高三9月月考一同学在“用双缝干涉测光的波长"实验中,使用的双缝的间距为0.02 cm,测得双缝与屏的距离为50 cm,第1级亮纹中心到第5级亮纹中心的距离为0.4 5 cm,则待测单色光的波长是 .
答案:4.5×10-7m
1. 河南省新郑州二中分校2010届高三第一次模拟利用油膜法估测油酸分子的大小,实验器材有:浓度为0.05 %(体积分数)的油酸酒精溶液、最小刻度为0.1 mL的量筒、盛有适量清水的45×50 cm2浅盘、痱子粉、橡皮头滴管、玻璃板、彩笔、坐标纸
下面是实验步骤:
A.用滴管将浓度为0.05 %的油酸酒精溶液一滴一滴地滴入量筒中,记下滴入1 mL油酸酒精溶液时的滴数N
B.将痱子粉均匀地撒在浅盘内水面上,用滴管吸取浓度为0.05%的油酸酒精溶液,从低处向水面中央一滴一滴地滴入,直到油酸薄膜有足够大的面积又不与器壁接触为止,记下滴入的滴数n
C. 将玻璃板放在浅盘上,用彩笔将油酸薄膜的形状画在玻璃板上
D.将画有油酸薄膜轮廓的玻璃板放在坐标纸上,以坐标纸上边长为1 cm的正方形为单位,计算轮廓内正方形的个数,算出油酸薄膜的面积S cm2
用已给的和测得的物理量表示单个油酸分子的大小_____________(单位:cm)
答案: 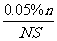 (6分)
(6分)
22.答案:(1)向左 不改变
(2)-77.6
(3)Cu(OH)2 Cu2++2NH3·H2O = Cu(OH)2↓ +2NH4+
(4)中 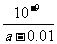 mol·L-1
mol·L-1
[解析](1)恒温、恒压条件下向平恒体系中通入氩气,则反应体系体积增大,平衡左移;使用催化剂只是改变了反应的途径,没有改变反应物与生成物的状态,△H不变;(2)利用盖斯定律,△H1+△H2+(-△H3)= -77.6 kJ·mol-1;(3)由于,KsP [Cu(OH)2]=2.2×10-20<Ksp[Mg(OH)2]=1.8×10-11,所以先生成沉淀;2NH3·H2O+Cu2+=Cu(OH)2↓+2 NH4*;根据溶液的电中性原则,c(NH4*)=c(Cl-),则[H+]=[OH-];溶液显中性;Kb= ,c(NH4*)=c(Cl-)=0.005 mol·L-1;[H+]=[OH-]=1×10-7 mol·L-1(因为是25℃下且为中性);[NH3·H2O]=mol·L-1-0.005 mol·L-1,则:Kb=mol·L-1。
21. 答案:(1)BD
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68kJ.mol-1
(3)H2O2分解速率加快
(4)2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
[解析](1)有关环保的比较容易。(2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。(3)考察影响化学反应速率的因素,结合双氧水的性质即可得出答案。(4)根据题目条件书写离子方程式常规题。
[考点分析]本题考察的知识比较散,一道题考察了几个知识点。覆盖面比较多。但盖斯定律,热化学方程式,离子方程式都是重点内容
20.答案:(1)水泥;△H1-3△H2+18△H3(2)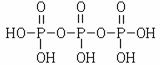 ,Na5P3O10,(3)+1;2Ni2+ + 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
,Na5P3O10,(3)+1;2Ni2+ + 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
[解析](1)①由方程式可以看出副产物矿渣应该是CaSiO3(s),结合炼铁我们不难得出答案是制水泥。
②运用盖斯定律,反应1-反应2×3+反应3×18=总反应,则△H=△H1-3△H2+18△H3
(2)结合题意三聚磷酸钠(俗称“五钠”)可知产物三聚磷酸应含有五个羟基,即三个
磷酸分子之间有三个羟基相互反应脱去两个水分子,所以三聚磷酸的结构式为
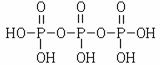 ,三聚磷酸钠的化学式为Na5P3O10。
,三聚磷酸钠的化学式为Na5P3O10。
(3)①因为Na、H的化合价为+1,O为-2,所以由化合价代数和为0可得P的化合价为:+1。
②由得失电子数目守恒(2-1)×2=(3-1)×1,可知Ni2+ 和Ni+的化学计量数为2,H2PO2-和
H2PO3-的化学计量数为1,再由电荷守恒2×2-1=2×1-1+2×1,可知H+在方程式的右边,H2O在方程式的左边,化学计量数分别为2和1。即总方程式为:2Ni2+ +1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+
③比较化学镀与电镀应该从反应环境和条件以及反应实质和产物方面去分析归纳问题,从方法上分析,电镀是利用电解原理通过外加直流电源,在镀件表面形成的镀层,镀层一般只有镍,而化学镀是利用氧化还原反应镀件直接与电解质溶液接触,在塑料镀件表面沉积镍-磷合金,这是两者的不同;从原理上分析,无论电镀还是化学镀均有电子的转移,均是利用了氧化还原反应,这是两者的相同点,不同点是化学镀用的是化学反应,而电镀用的是电化学;很明显化学镀装置简单,而且不需要消耗电能,装置简单、耗能少、操作简便应该是化学镀优于电镀的。
19.答案:(1) (2)弱于
(2)弱于
(3)S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
(4)2H2O2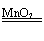 2H2O+O2↑(或其他合理答案:)
2H2O+O2↑(或其他合理答案:)
(5)NaNO2
(6)(3a – 4b)kJ/mol
[解析]本题考查无机物的性质,涉及化学用语、方程式书写、氧化还原反应以及热化学的知识。从给出的表,结合T在周期表的位置与族数相等这一条件
,不难得出T为Al,Q为C,R为N,W为S。(1)T为Al,13号元素。(2)S、C最高价氧化物对应的酸为硫酸强于碳酸,则可得非金属性S强于C。(3)S与H2SO4发生归中反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价看,只能是SO2。(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应。(5)N中相对分子质量最小的氧化物为NO,2NO+O2=2NO2,显然NO过量1L,同时生成1L的NO2,再用NaOH吸收,从氧化还原角度看,+2价N的NO与+4价N的NO2,应归中生成+3N的化合物NaNO2。(6)C
+O2 CO2△H=-a kJ/mol①,4Al+3O2=2Al2O3△H= -4bkJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al+3CO2
CO2△H=-a kJ/mol①,4Al+3O2=2Al2O3△H= -4bkJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al+3CO2 3C+2Al2O3,此反应的△H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)kJ/mol。
3C+2Al2O3,此反应的△H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)kJ/mol。
18. 答案:(1)二 VA 弱
(2)1s22s22p63s23p4 大
(3)Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
(4)3FeO(s) + 2Al(s) Al2O3(s) + 3Fe(s)
△H=-859.7KJ/mol
Al2O3(s) + 3Fe(s)
△H=-859.7KJ/mol
[解析]首先推出题中几种元素,W、Y的氧化物是导致酸雨的主要物质,在结合原子序数的大小可知,W是氮元素,Y是硫元素,X的基态原子核外有7个原子轨道填充了电子,根据基态原子核外电子所遵循的原则,可以写出电子排布式为:1s22s22p63s23p1,X为铝元素,Z能够形成红色的Z2O和黑色的ZO两种氧化物,推知Z为铜元素,两种氧化物分别为Cu2O和CuO。
17.答案:(10分)(1)abcd (2)a c
(3)①3Fe+4H2O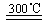 Fe3O4+2H2 ②c ③e
Fe3O4+2H2 ②c ③e
[解析]控制和治理CO2是解决温室效应的有效途径可以控制源头,也可以吸收大气中CO2,光合作用利用了太阳能为最节能,反应物中的原子全部转化为有机物,为原子利用率最高。由反应原料为铁和水,故3Fe+4H2O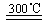 Fe3O4+2H2,使用催化剂可加快反应速率,根据CH4、HCOOH、H2的产量和镍粉用量的关系图可知,反应Ⅱ的速率均增加得快。
Fe3O4+2H2,使用催化剂可加快反应速率,根据CH4、HCOOH、H2的产量和镍粉用量的关系图可知,反应Ⅱ的速率均增加得快。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com